Sommaire
- Continued Process Verification stratégie de visualisation des données dans le cadre de la CPV
- Démarche de déploiement de la Vérification Continue des Procédés & gains associés, sur un site de production pharmaceutique
- Intervalles statistiques de tolérance : Quelles alternatives en cas de non-normalité ?
- Comment construire une stratégie d’échantillonnage adaptée en fonction des risques
- Sécurisation des approvisionnements : stratégie & outils pour maitriser les risques de rupture
- Advanced Data Analysis as an enabler to near real-time Contamination Control Strategy Evaluation
- L’IA diagnostic. L’analyse d’images
Démarche de déploiement de la Vérification Continue des Procédés & gains associés, sur un site de production pharmaceutique
La Vérification Continue des Procédés (CPV) est un processus clé et cyclique, visant à accroitre les performances industrielles et à répondre aux objectifs d’Excellence Opérationnelle recherchés par les industries du médicament. Bien que l’activité soit réglementaire assurant le maintien du statut validé d’un procédé de fabrication, la CPV constitue surtout une opportunité de faire collaborer les équipes pour détecter précocement, investiguer et corriger les dérives liées aux activités à fortes valeurs ajoutées, mais aussi de gagner en connaissance sur les opérations de terrain.
Un autre aspect important de la surveillance maîtrisée via la CPV est le gain financier conséquent qu’elle génère ou les pertes financières qu’elle permet d’éviter, nous parlons ici de plusieurs milliers à millions d’euros selon le procédé étudié et la valeur ajoutée du produit.
Le déploiement de la démarche CPV dans une industrie pharmaceutique constitue un véritable défi et bouscule généralement l’organisation en place par la forte transversalité de l’activité auprès des équipes supports et opérationnelles.
Il est impératif de prendre en considération que le déploiement de la CPV est une démarche d’amélioration continue de la qualité, qui doit être intégrée dans le système qualité pharmaceutique existant, comme l’évoque l’article La Vague n°62 de juillet 2019.
1. Les exigences réglementaires
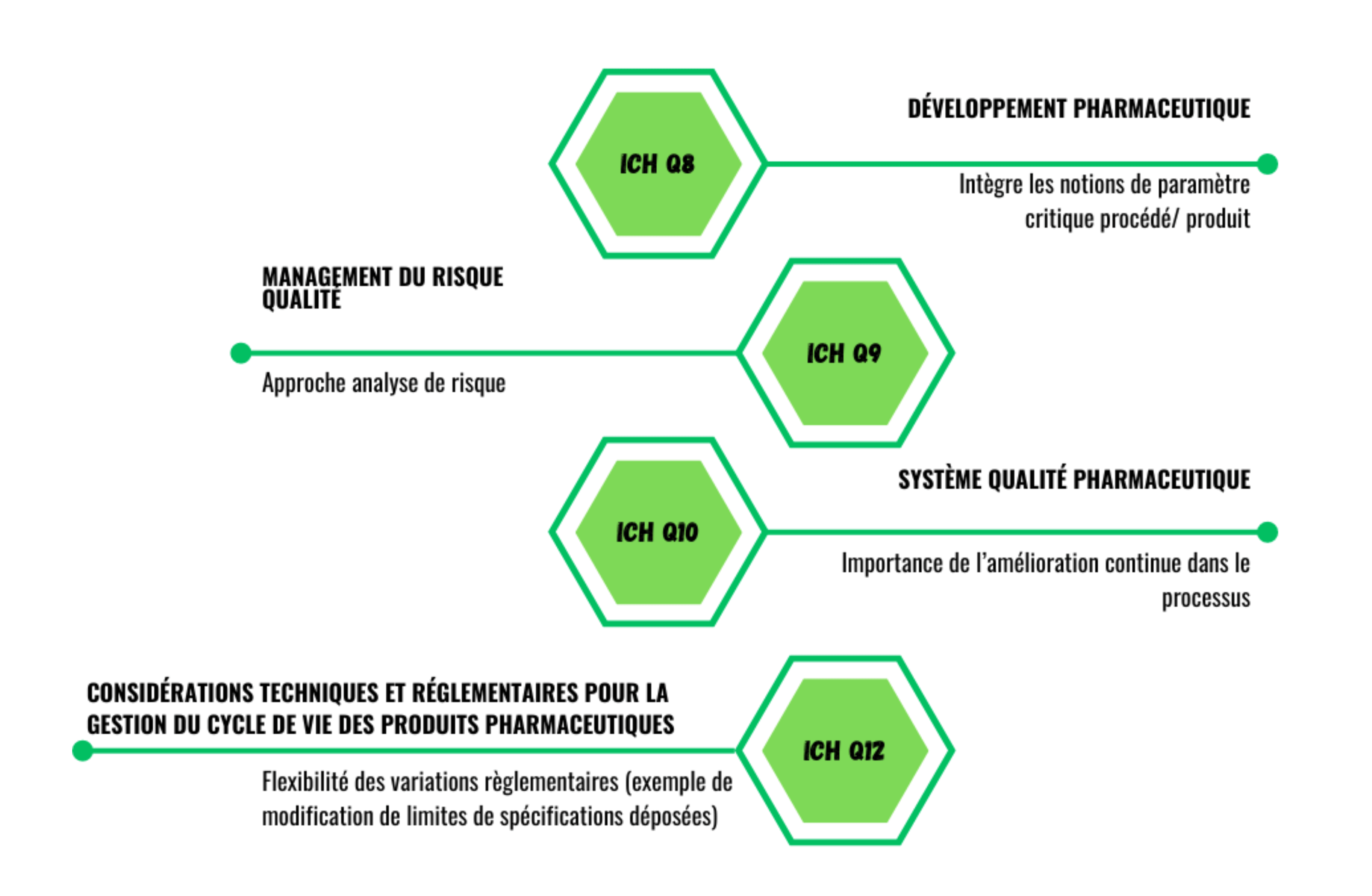
Le contexte réglementaire ayant déjà été abordé dans un article du numéro 62 de la Vague, il est important de notifier qu’en pratique, ce sont surtout les ICH Q8, Q9, Q10 et Q12 qui seront utilisées comme référentiels pour implémenter le processus CPV. Elles présentent chacune les directives essentielles au bon déroulement de l’activité qui proviennent du guide FDA “Guidance for Industry Process Validation: General Principles and Practices” (2011) et du guide EMA “Guideline on process validation for finished products – information and data to be provided in regulatory submissions” (2016).
2. Le déploiement de la démarche CPV : un projet d’amélioration continue
Le déploiement de la CPV via un projet d’amélioration continue avec le support d’une équipe projet multidisciplinaire est un facteur clé de succès. Pour implémenter un programme CPV, il est fortement préconisé d’utiliser une méthodologie de déploiement scientifique structurée, afin de :
- Répondre aux exigences réglementaires
- Répondre aux objectifs de performance / business de l’entreprise.
- Structurer la mise en place de la démarche pas à pas en impliquant toutes les parties prenantes. Standardiser le processus.
- Garantir la fluidité, l’efficacité et la pérennité du processus, qui rappelons-le, doit être continu.
2.1. Les outils pour un déploiement de la démarche CPV pas à pas
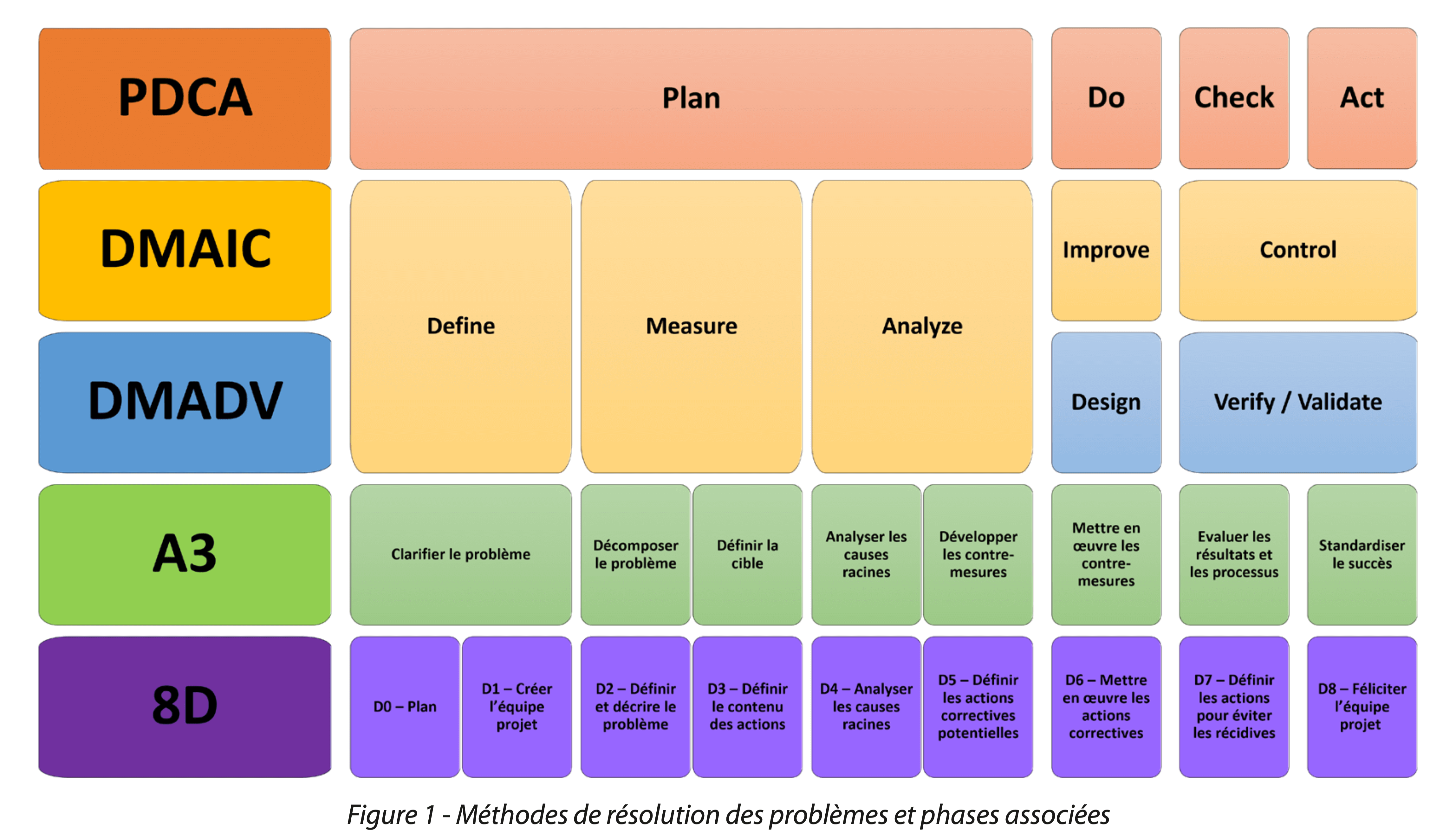
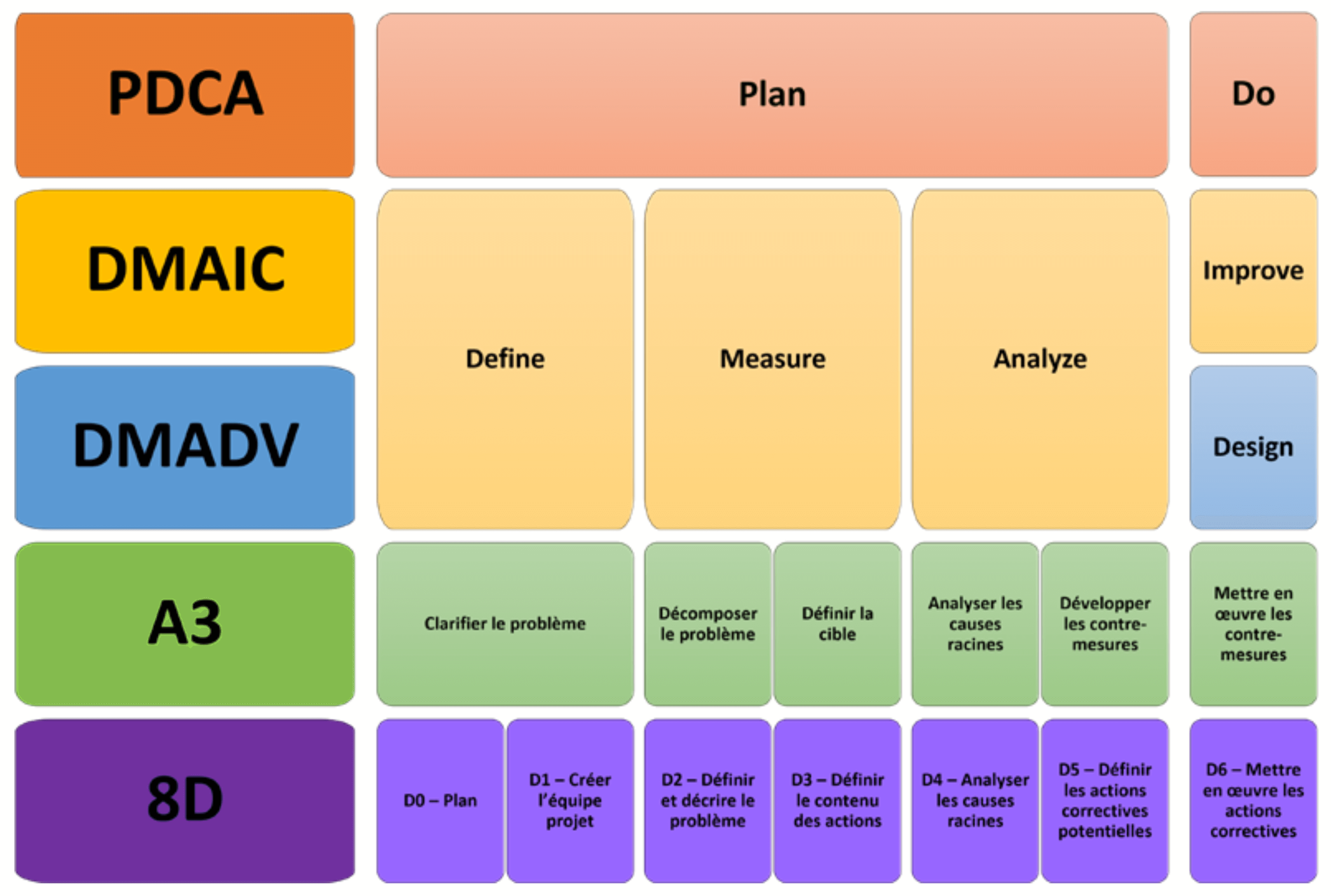
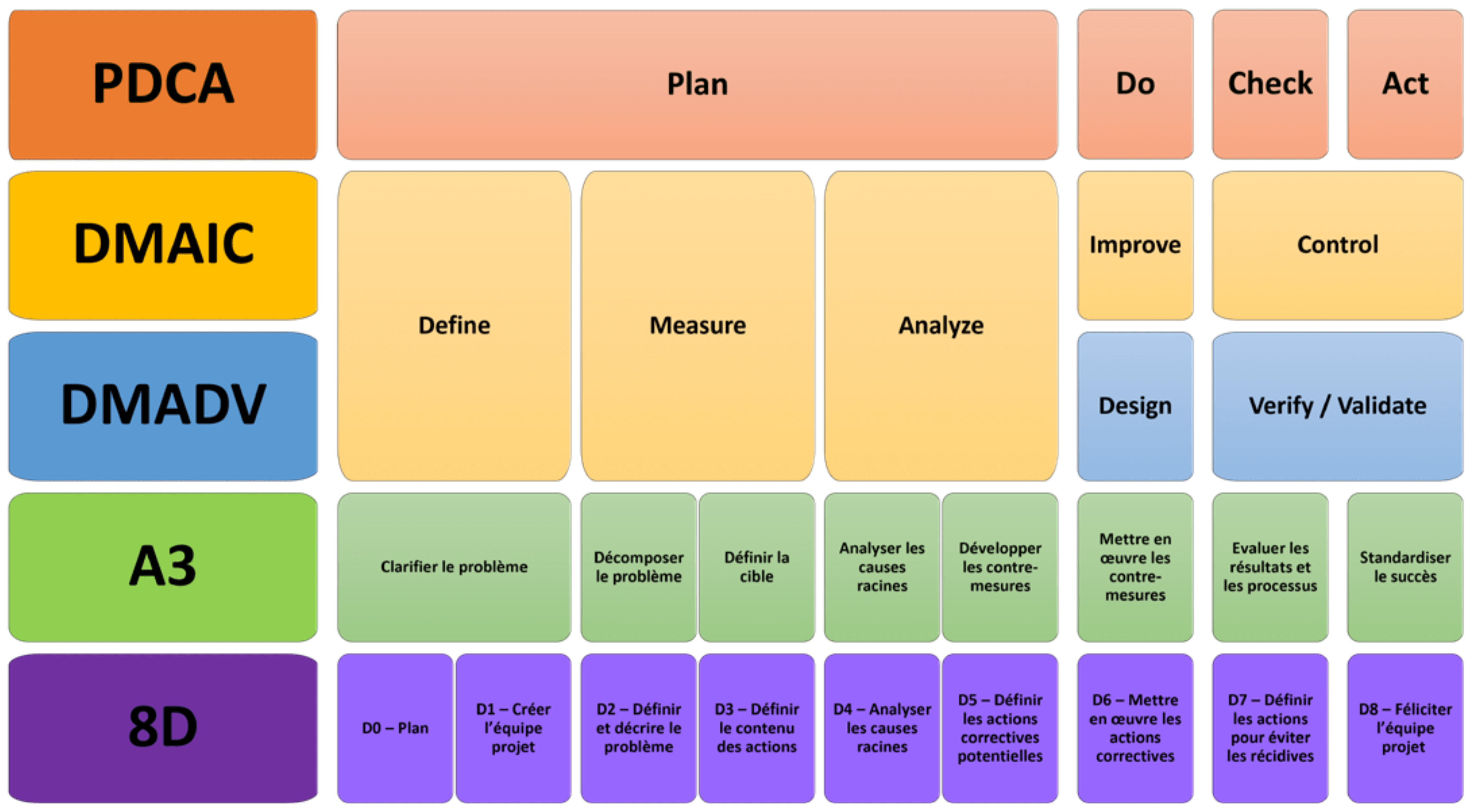
L’utilisation de l’une des méthodes de résolutions de problèmes telles que PDCA (Plan, Do, Check, Act), DFSS (Design For Six Sigma) qui s’articule autour des étapes DMADV (Define, Measure, Analyze, Design, Validation), DMAIC (Define, Measure, Analyze, Improve, Control), A3, 8D…, est fortement recommandée pour déployer de façon structurée la démarche CPV (figure 1). Les objectifs des phases de chaque méthode sont identiques, il conviendrait de choisir la démarche appropriée en fonction de la problématique d’implémentation de la CPV au sein de son entreprise. Ici, l’exemple s’appuie sur une méthode DMADV. (figure 1)
2.2. Phase Define. Définir le problème et les enjeux
La première étape de la méthodologie consiste à définir la problématique et les enjeux du déploiement de la CPV. Elle permet au travers d’une charte projet de :
- Faire l’état des lieux de l’organisation en place en s’appuyant sur une cartographie simplifiée (ex : SIPOC), de la situation de l’activité CPV dans l’entreprise et de la maturité du site en termes de politique d’amélioration continue.
- Définir les besoins et attentes des clients internes et externes vis-à-vis du déploiement de la démarche CPV, en accord avec les objectifs de l’activité.
- Définir les opportunités de déploiement de l’activité :
- l’opportunité qualité (ex : anticipation des non-conformités, élimination des rejets),
- l’opportunité financière (ex : coût des gains / économies réalisées),
- l’opportunité de la collaboration entre les départements (ex : investigation multidisciplinaire, fluidification des processus),
- l’opportunité Intellectuelle (ex : enrichissement de la connaissance des procédés/produits) et,
- l’opportunité Client (interne/externe). Ex : accélération du temps d’investigation par la mise à disposition immédiate des données).
- Définir une équipe projet : Le sponsor du projet est identifié au sein du comité de Direction et est un facilitateur de l’allocation des ressources. L’équipe projet multidisciplinaire est composée des acteurs clés de l’activité, à savoir, sans que ceci soit exhaustif, la Validation / équipe CPV, la Production, l’Engineering, le Laboratoire de contrôle qualité, la Qualité, le service d’Amélioration Continue, le Business/les Finances.
- Définir les rôles et responsabilités dans le processus CPV : Le critère primordial est d’attribuer les bonnes compétences aux bonnes fonctions, le RACI pourrait être utilisé en conséquence. En général, les équipes Production, Qualité, CPV, d’amélioration continue (si l’organisation le permet), business supportent le projet dans les fonctions respectives de collecte, intégrité, analyse des données, amélioration des procédés, et d’évaluation des gains et coûts etc.
- Le planning et le budget associé : Enfin, comme tout projet d’amélioration continue, un planning est indispensable pour garantir les délais de déploiement qui peuvent être très variables en fonction des organisations et de la maturité du site dans la gestion des données. La durée d’un projet de déploiement de la CPV est, toute proportion gardée, d’un an minimum. Les coûts du projet de déploiement doivent également être définis.
Exemple de questions liées l’étape DEFINE
|
2.3. Phase Measure. Mesurer l’ampleur de la tâche de déploiement et sa faisabilité
Il s’agit d’un état des lieux plus approfondi qui peut s’appuyer sur une cartographie détaillée du processus et sur les données d’entrée de chacun des membres de l’équipe projet, afin d’estimer la faisabilité du projet. L’analyse de déroulement est un outil efficace pour réaliser cette étape. Ainsi, l’équipe projet identifie et décrit :
- L’organisation des ressources, les outils disponibles ou manquants et indispensables au déploiement du processus CPV.
- Les “goulots d’étranglement”, les étapes critiques, pouvant faire dysfonctionner le processus.
L’application de la technique du GEMBA WALK en équipe sur l’ensemble du processus cartographié est fortement recommandée, afin d’être le plus exhaustif possible. Ainsi, il peut être mis l’accent sur les exigences “Must Have” et les souhaits “Nice to have” du processus CPV.
Exemple de questions liées l’étape MEASURE
|
2.4. Phase Analyze. Analyser le problème pour concevoir une solution
L’étape d’analyse du problème permet d’investiguer de manière approfondie sur les goulots d’étranglement du processus, afin de proposer des solutions qui répondront aux exigences et aux souhaits de déploiement du processus CPV.
Les techniques tels que le Pareto / 5 Pourquoi / brainstorming permettent de capturer un flux d’idées avant de prendre les décisions sur les points les plus critiques et bloquants pour le déploiement.
Les besoins financiers et les investissements potentiels doivent également être révélés dans cette phase (investissement dans un logiciel de collecte automatique de données, engagement du personnel pour mener l’activité CPV etc..).
Exemple de questions liées l’étape ANALYZE
|
2.5. Phase Design. Conception de la démarche CPV
La phase “Design” répond aux problématiques ciblées en troisième phase en proposant un ensemble de solutions dont la priorisation sera réalisée en fonction du rapport gains / efforts de mise en place. L’objectif de cette phase de conception est de générer des solutions afin de réduire considérablement, voire éliminer, les goulots d’étranglement, ou les origines du problème lié à un potentiel échec antérieur du déploiement.
Cette phase permet notamment de redistribuer de manière optimale la valeur ajoutée en fonction des compétences / objectifs des acteurs de l’activité vis-à-vis de leur fonction au sein de leur propre service.
Par exemple :
- Les étapes de collecte et de revue en temps réel des tendances sont attribuées aux propriétaires des données pour expliquer les tendances.
- L’étape de la re-vérification des données sera gérée par l’Assurance Qualité, lors de la revue Qualité des dossiers de lots.
Cette phase de conception vise à tester un déploiement pilote avec l’ensemble des solutions sélectionnées, elle passe donc par une phase intensive de formation du personnel, de partage des connaissances acquises lors du projet, de création de la documentation maître (procédure, trames de documentation techniques, outils statistiques, fichiers de suivi d’indicateurs de performances…) afin d’implémenter un processus fluide et performant.
Exemple de questions liées l’étape DESIGN
|
2.6. Phase Verify. Vérification du déploiement de la démarche CPV au sein de l’entreprise
Dans la phase de Vérification, le déploiement de la démarche CPV est terminé, testé et officialisé dans l’entreprise auprès des clients internes et externes. Elle a pour but de vérifier que les solutions identifiées en phase “Design” sont efficientes et durables. Des corrections devront être apportées le cas échéant.
La surveillance des performances du nouveau processus de déploiement de la CPV est donc indispensable pour corriger les dysfonctionnements potentiels d’organisation des équipes ou des outils, qui n’ont pas été révélés lors des phases Analyse et Design. Le suivi est important pour comprendre si tous les bénéfices attendus ont réellement été atteints.
Enfin, le processus est remis au propriétaire, en général, le service Assurance qualité ou Industrialisation.
Exemple de questions liées l’étape VERIFY
|
3. Mise en application d’un programme CPV sur un médicament de forme solide orale
L’étude de cas suivante est issue d’un programme CPV réel, déployé sur un médicament de forme solide orale. Ce suivi met en évidence les bénéfices de la démarche, aussi bien d’un point de vue Qualité que Business. Cet exemple est en phase 3b de la CPV, les éléments de suivi, ainsi que les limites de contrôle ont donc été définis selon un référentiel 3a, réalisé dans une période appropriée de 1 an (cf. Guide CPV A3P pour le détail).
3.1. L’étape 3a CPV : un outil essentiel pour comprendre la variabilité inhérente au procédé
Au cours de cette étape les données critiques issues du procédé de fabrication ont été collectées sur un ensemble de 25 lots produits en 1 an, et analysées afin de calculer, puis fixer des limites de contrôle. Ces dernières reflètent le “comportement réel du procédé” c’est-à- dire en prenant en compte les sources de variations sur le procédé de fabrication du médicament. Il est primordial d’avoir un procédé dont la variation est essentiellement inhérente (variation naturelle), une correction du procédé devra être menée le cas échéant. Une fois mis sous-contrôle, le suivi du médicament passe ensuite en étape 3b.
3.2. L’étape 3b CPV du médicament : utiliser des signaux du procédé pendant la surveillance de routine
a) Alerte sur une dérive du procédé
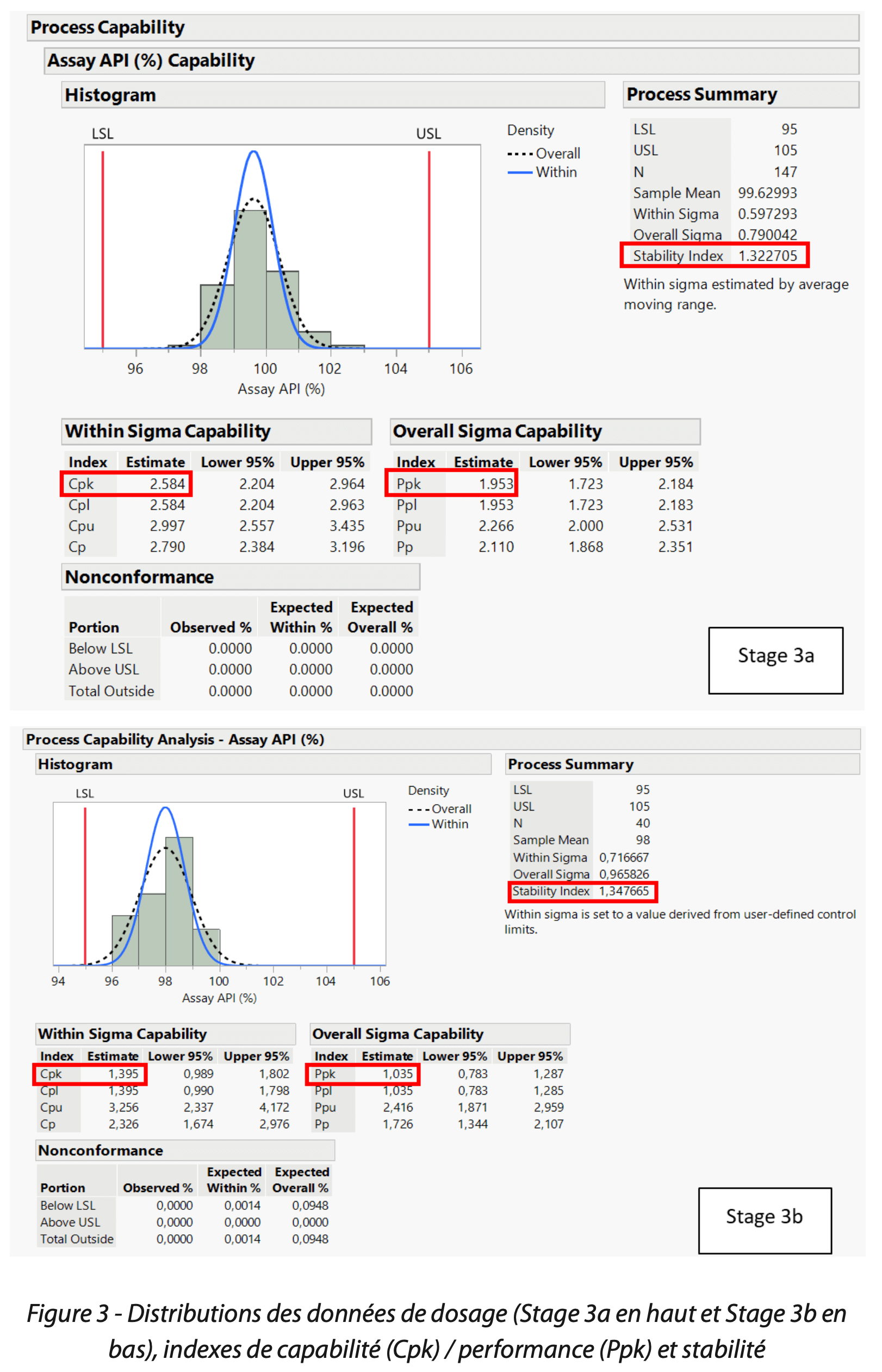
La première opération de routine au cours d’un suivi du médicament en étape 3b est de visualiser la position et dispersion des données. Cette observation a été réalisée par le laboratoire via la génération d’une carte de contrôle individuelle, représentant le “film du comportement du procédé” dans le temps (Figure 2). La carte de contrôle a ainsi mis en évidence une tendance basse du dosage du principe actif, ayant alors un impact direct sur l’efficacité du produit. La distribution des données ainsi que les indices de capabilité Cpk 1,4 / performance Ppk 1,0 / stabilité 1,32 (Figure 3), comparés à l’étape 3a (capabilité Cpk 2,6 / performance Ppk 2,0 / stabilité 1,35), ont confirmé un écart.
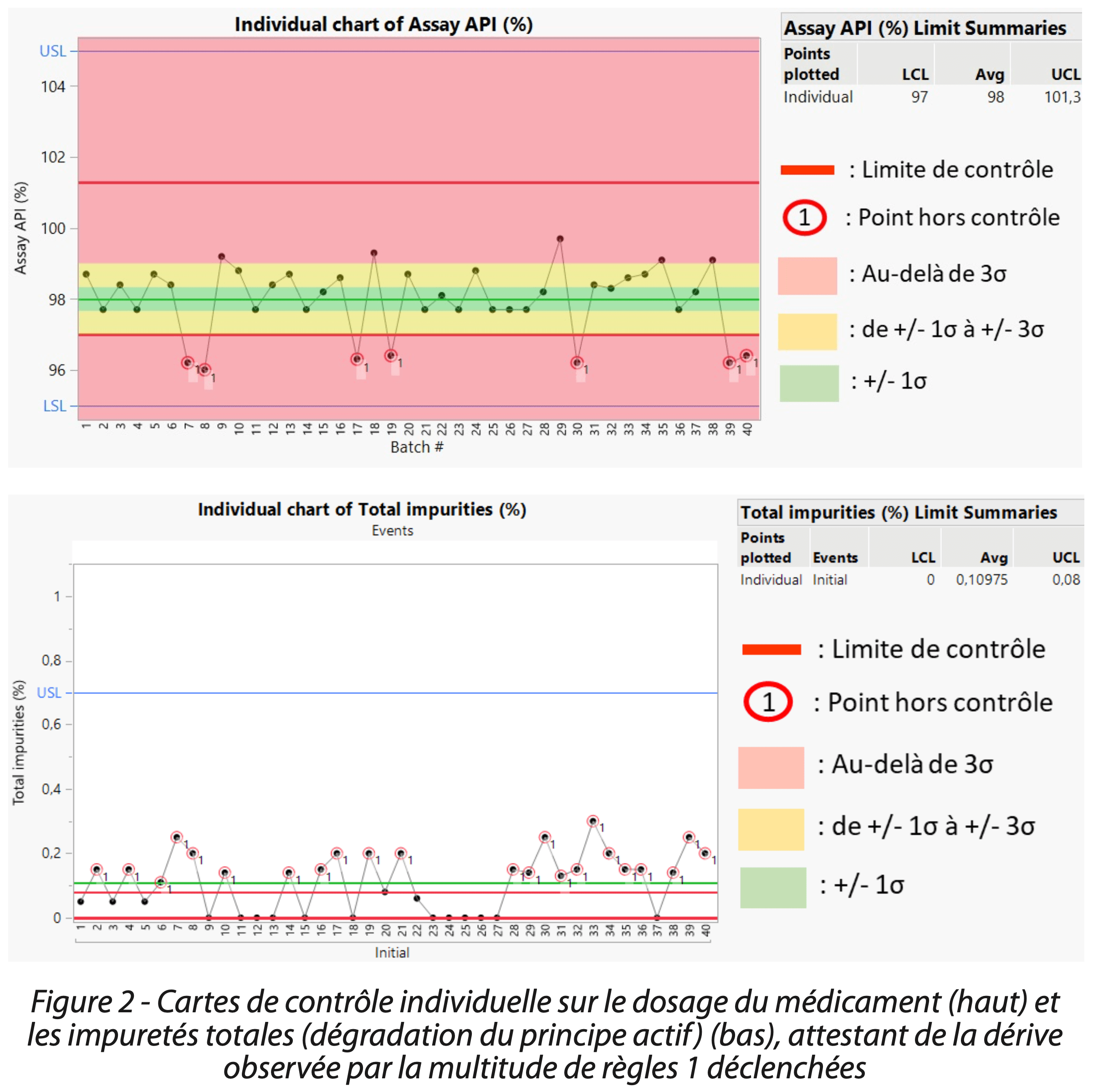 |  |
b) Début de l’investigation : capitalisation des connaissances sur le procédé
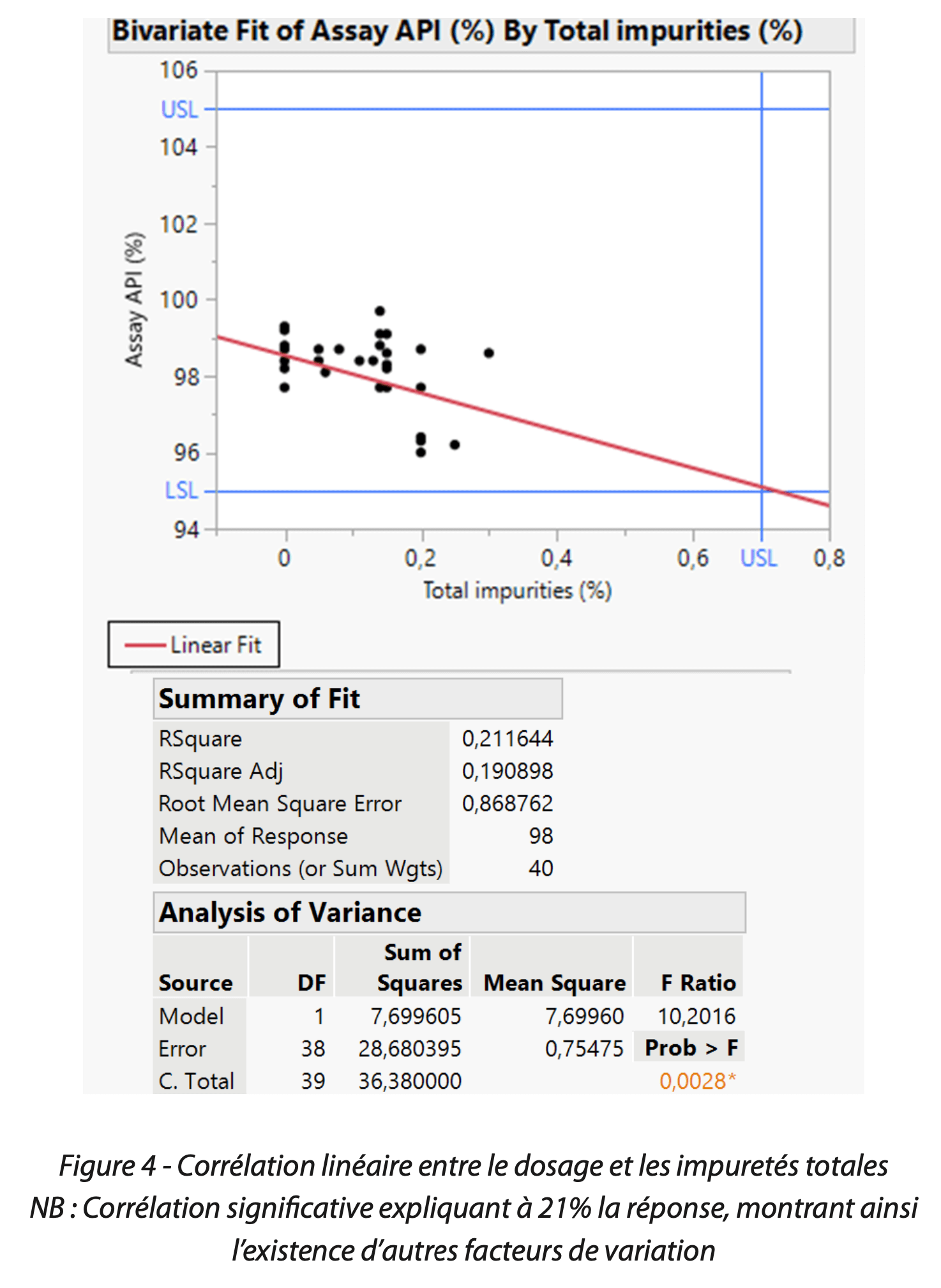
Selon l’expert procédé, le produit en question est connu pour être sensible à la dégradation de l’actif. Ainsi, le suivi des impuretés totales via la carte de contrôle individuelle, ainsi que l’étude de corrélation avec le dosage final réalisée par l’équipe CPV, ont permis de mettre en évidence cette dégradation à libération (Figure 4).
c) Recherches des causes de la dérive
Les étapes critiques du procédé pouvant générer la dégradation, sélectionnées selon le Pareto, ont été passées en revue pour rechercher les causes de la dérive (la pesée du principe actif, son conditionnement et chargement, les conditions environnementales, etc).
Suite à l’élimination des causes potentielles via un travail inter- départements, l’investigation a finalement mené aux étapes de pesée. Il a alors été observé que le principe actif était reçu et chargé en sacs de faible contenance. Le produit contenant une très grande quantité de principe actif, ce constat annonce une multiplication des étapes de déchargement/chargement par les opérateurs, susceptible de créer une très grande instabilité pour l’actif.
d) Identification de la solution
L’utilisation d’un contenant avec une plus grande capacité de charge est une amélioration qui a ainsi été ciblée par les experts procédés. Cette solution a fortement limité le nombre de manipulations, empêchant à la fois la perte de poudre liée à la multiplication des opérations ainsi que la limitation du temps d’exposition du principe actif à l’environnement ambiant (cause de dégradation) et à l’humain (bénéfice sécurité).
e) Mise en place des améliorations pour l’excellence opérationnelle
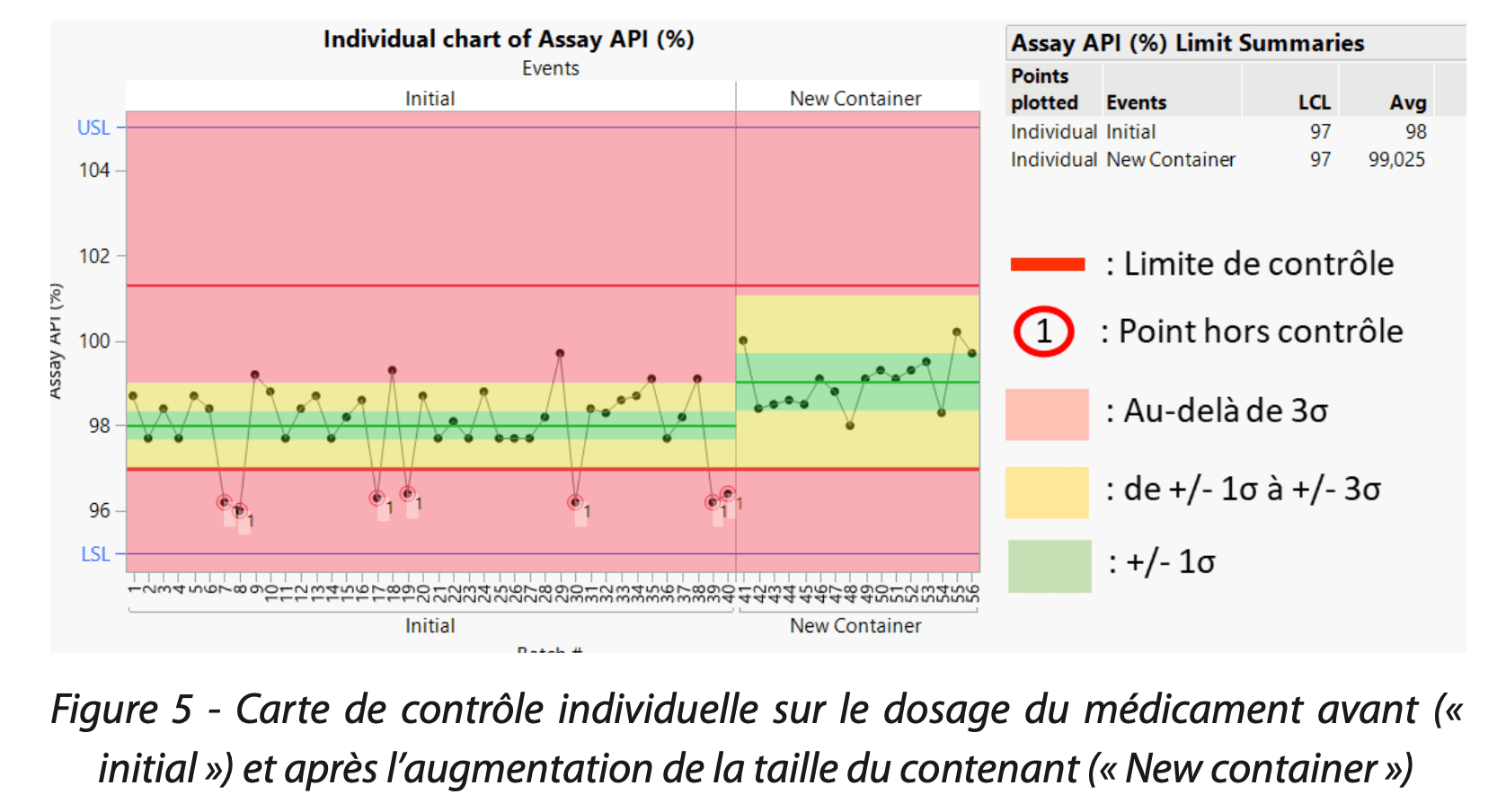
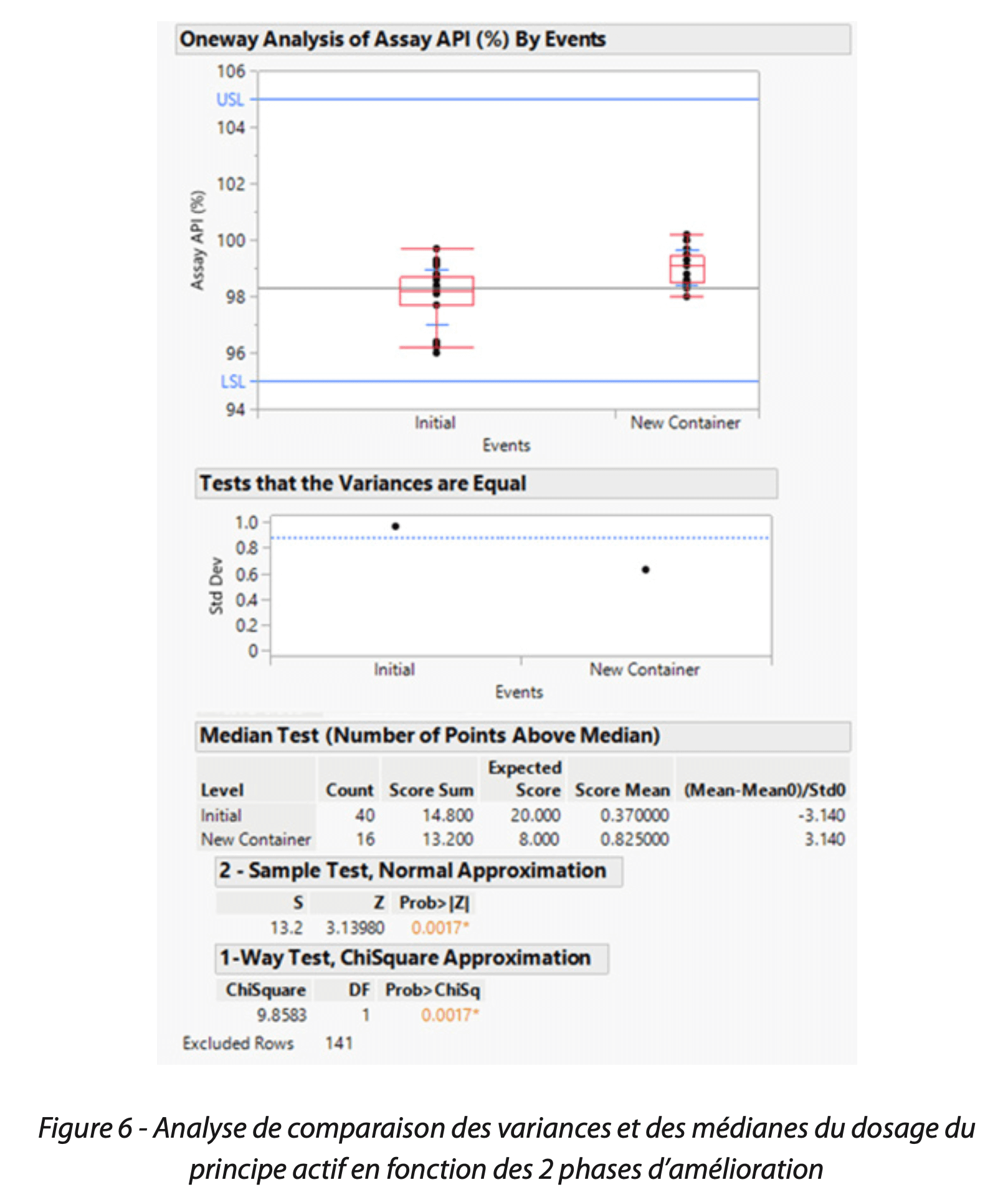
1ère solution. Suite à la mise en place d’un contenant de plus grande capacité, le suivi continu des données de dosage (Figure 5) et la comparaison de la phase initiale à la phase post-changement, a permis de constater une élévation de la tendance.
Cet écart positif a pu être démontré par un test d’hypothèse de comparaison des médianes (Figure 6). Cependant, bien que l’impact sur le dosage ait été confirmé, les impuretés totales, bien qu’en plus faible quantité, étaient toujours présentes (Figure 7).
 | 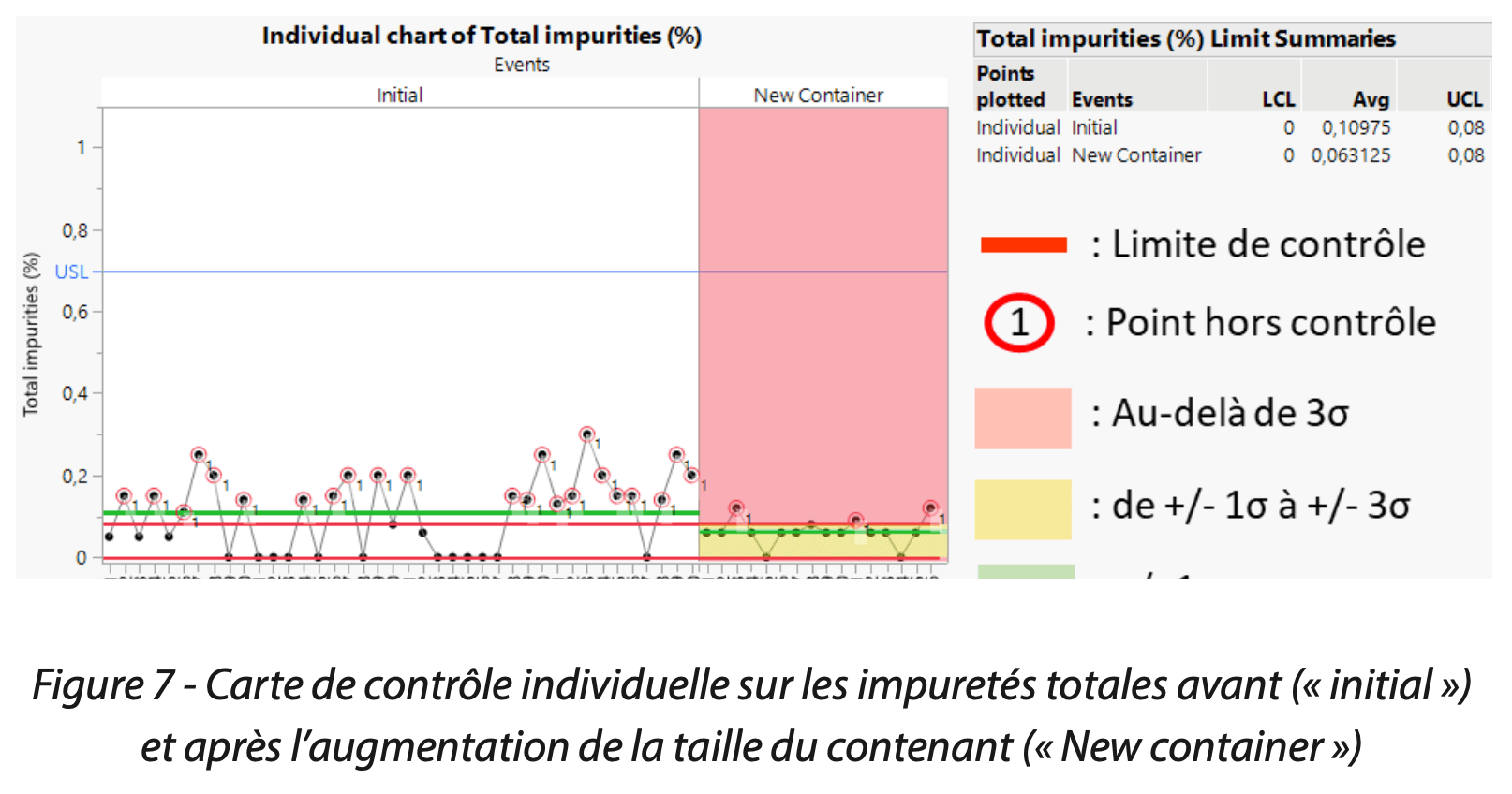 |
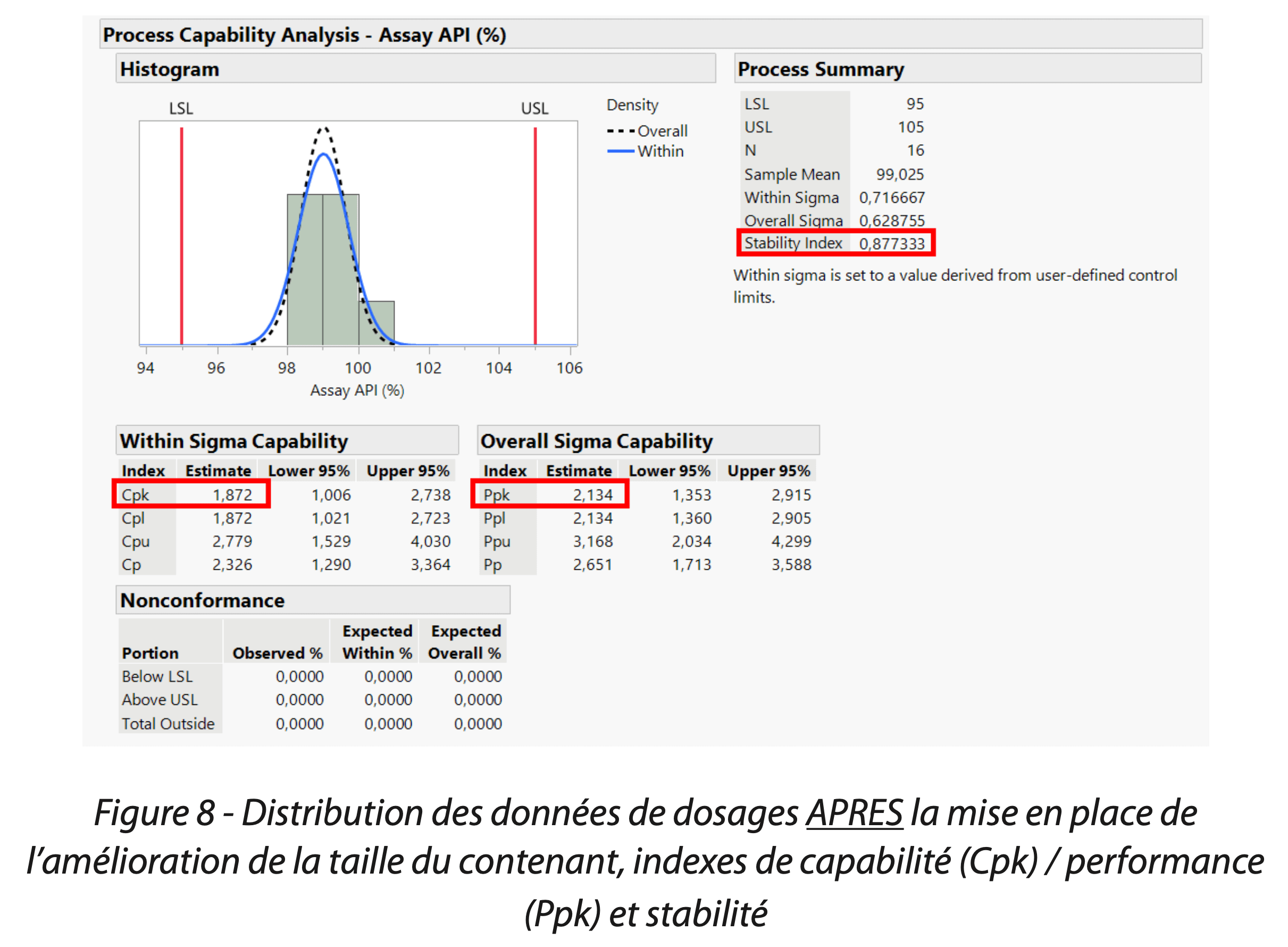
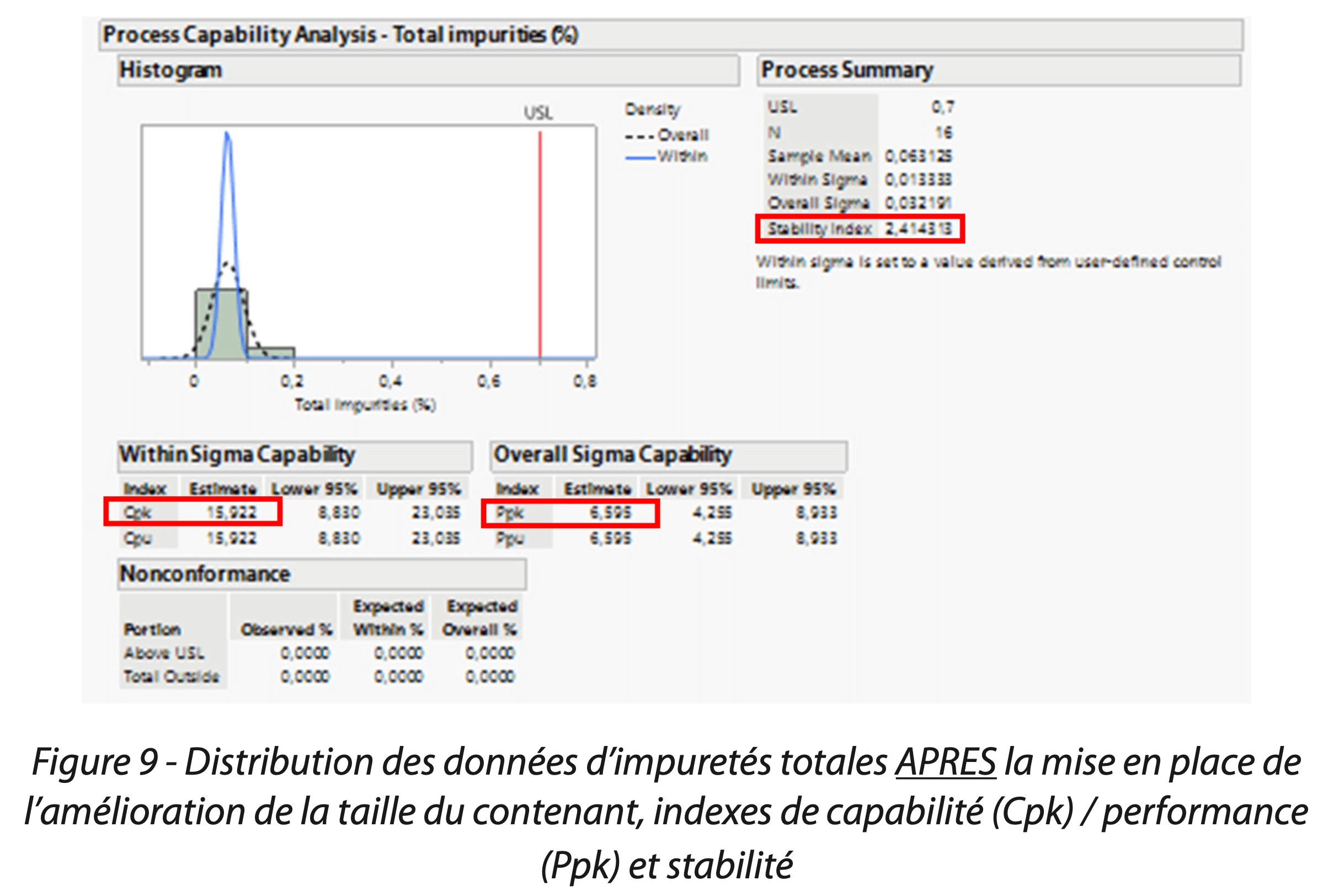
La distribution des données ainsi que les indices de capabilité Cpk 1,9 /performance Ppk 2,1/ stabilité 0,9 en Figure 8 (pour le dosage) et de Cpk 15,9 / Ppk 6.595 / stabilité 2.4 (pour les impuretés totales du principe actif) en Figure 9 montrent une nette amélioration suite à la mise en place de la solution.
 |  |
La connaissance produit ayant déjà démontré l’impact critique de cette dégradation, une autre solution devait être apportée pour l’éliminer.
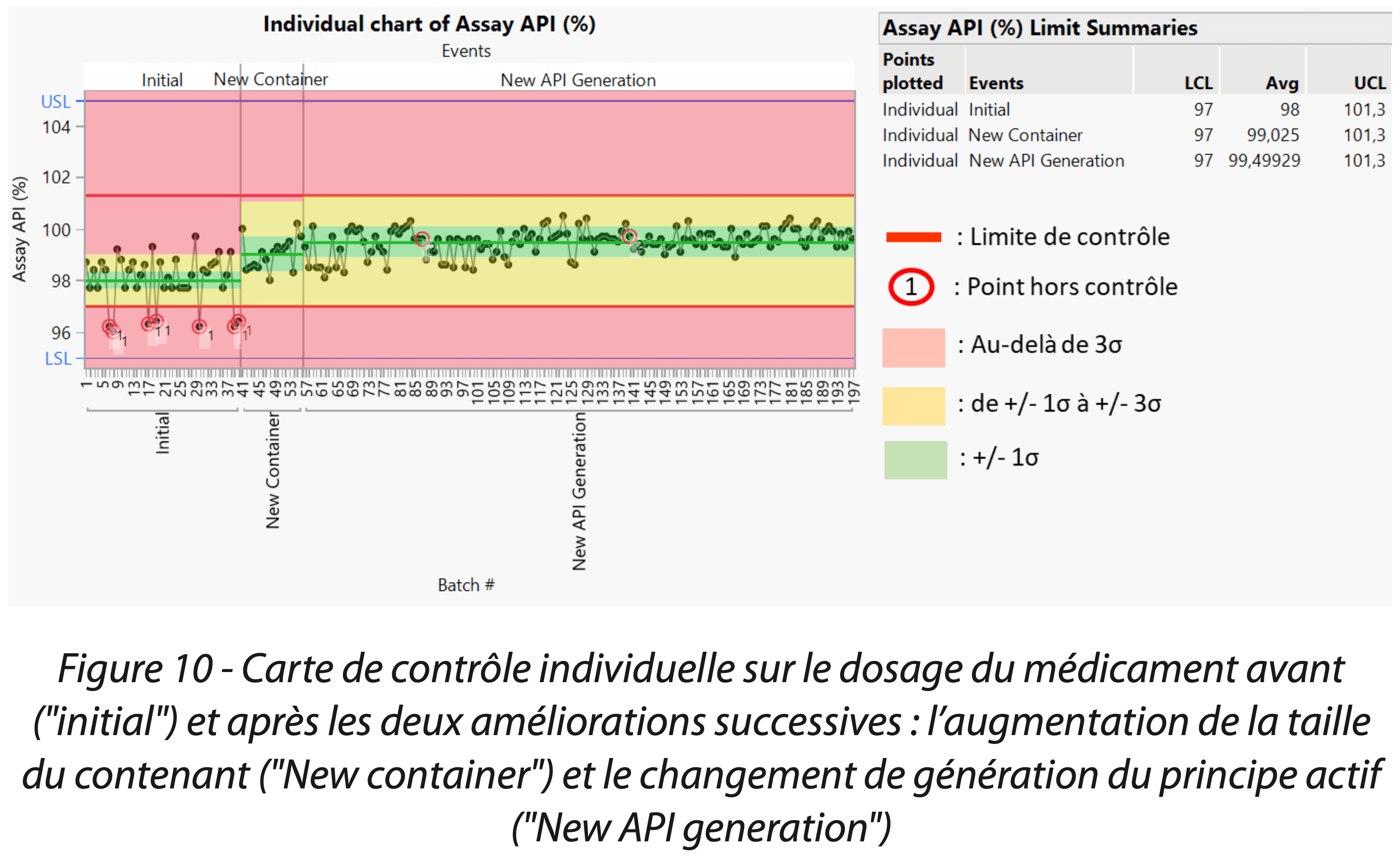
2ème solution. Les procédés de fabrication et de contrôle du principe actif réalisés par le fabricant ainsi que les résultats de dosage à la libération ont donc fait l’objet d’une revue approfondie. L’équipe CPV a observé que le dosage moyen du principe actif pur était bas, et que le seuil d’alerte de détection des impuretés totales était trop haut pour observer une dégradation. En ce sens, le partage des données et des connaissances du produit entre les équipes a permis l’amélioration du procédé pour limiter au maximum la dégradation, et les seuils d’alerte abaissés. La seconde amélioration a donc été d’améliorer, dans son ensemble, le procédé de production du principe actif. Les attributs de la matière active entrante ayant été modifiés, le procédé de fabrication du produit a naturellement été revalidé. Les premiers résultats de validation étant concluants et en adéquation avec une production commerciale. La surveillance du procédé via le processus annuel de suivi CPV du dosage sur les lots commerciaux s’est poursuivie. Il a été ainsi mis en évidence une tendance du dosage de principe actif en augmentation jusqu’à la cible de 100%, accompagné d’une réduction puis stabilisation de la variabilité (Figure 10).
 | 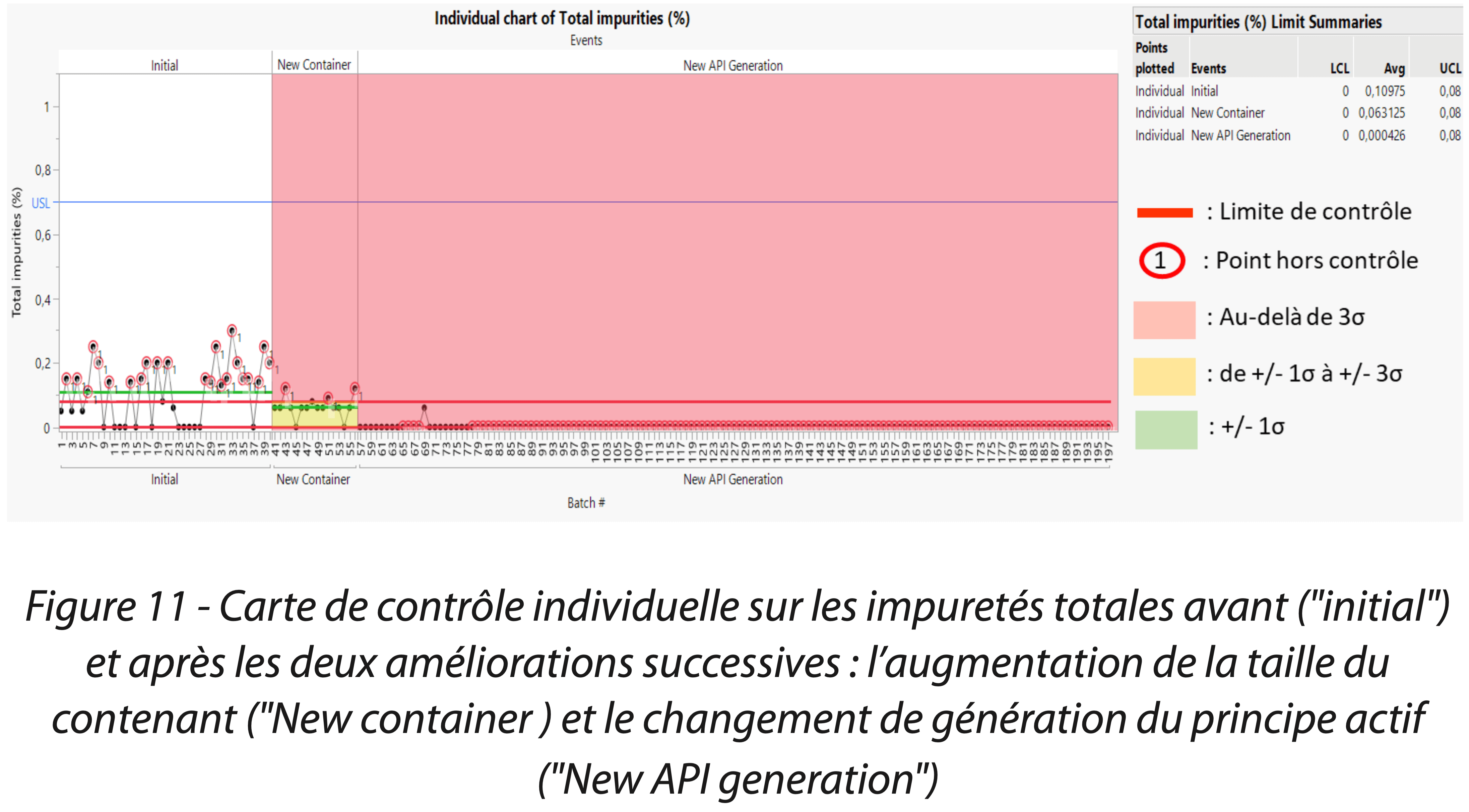 |
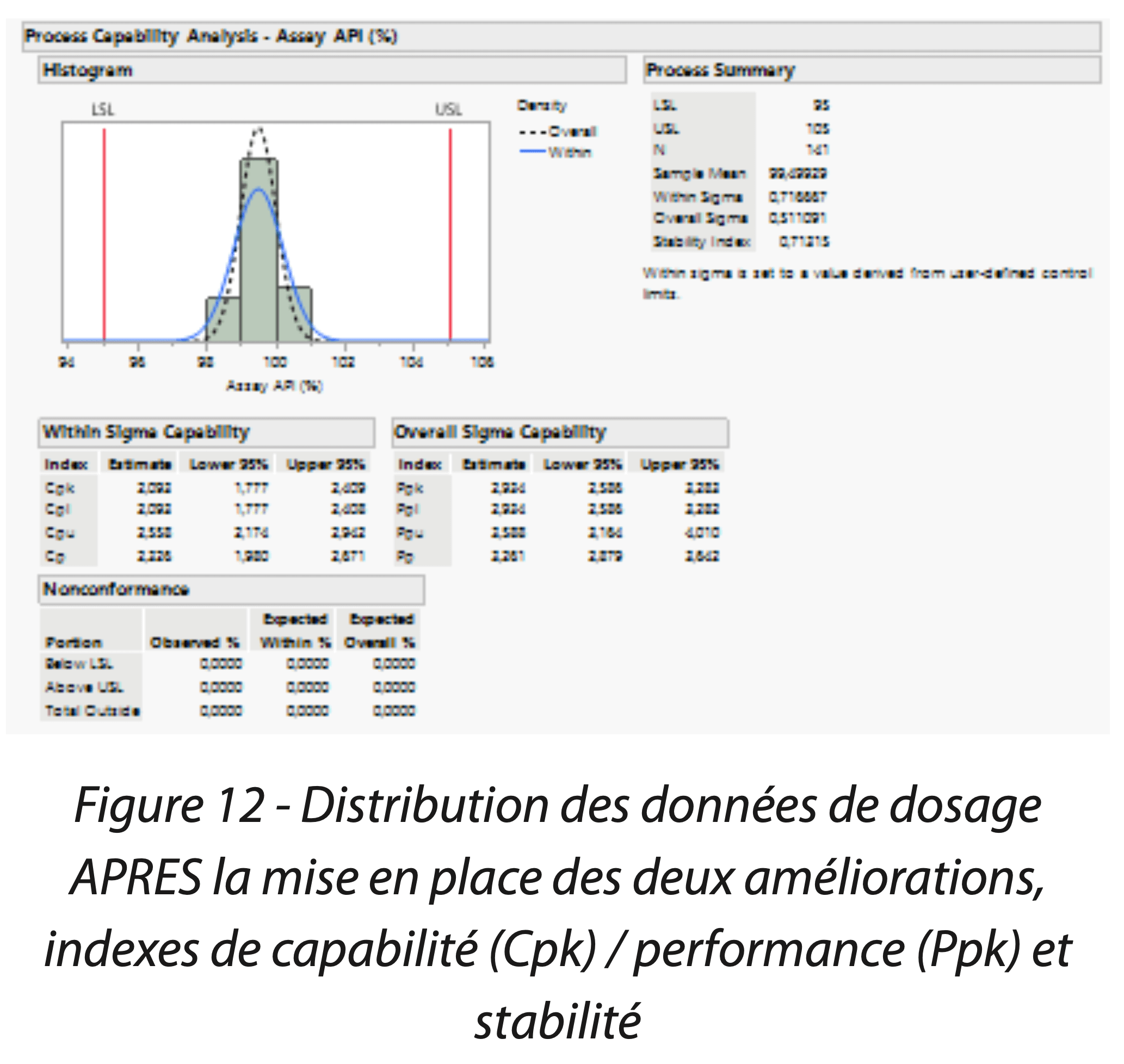
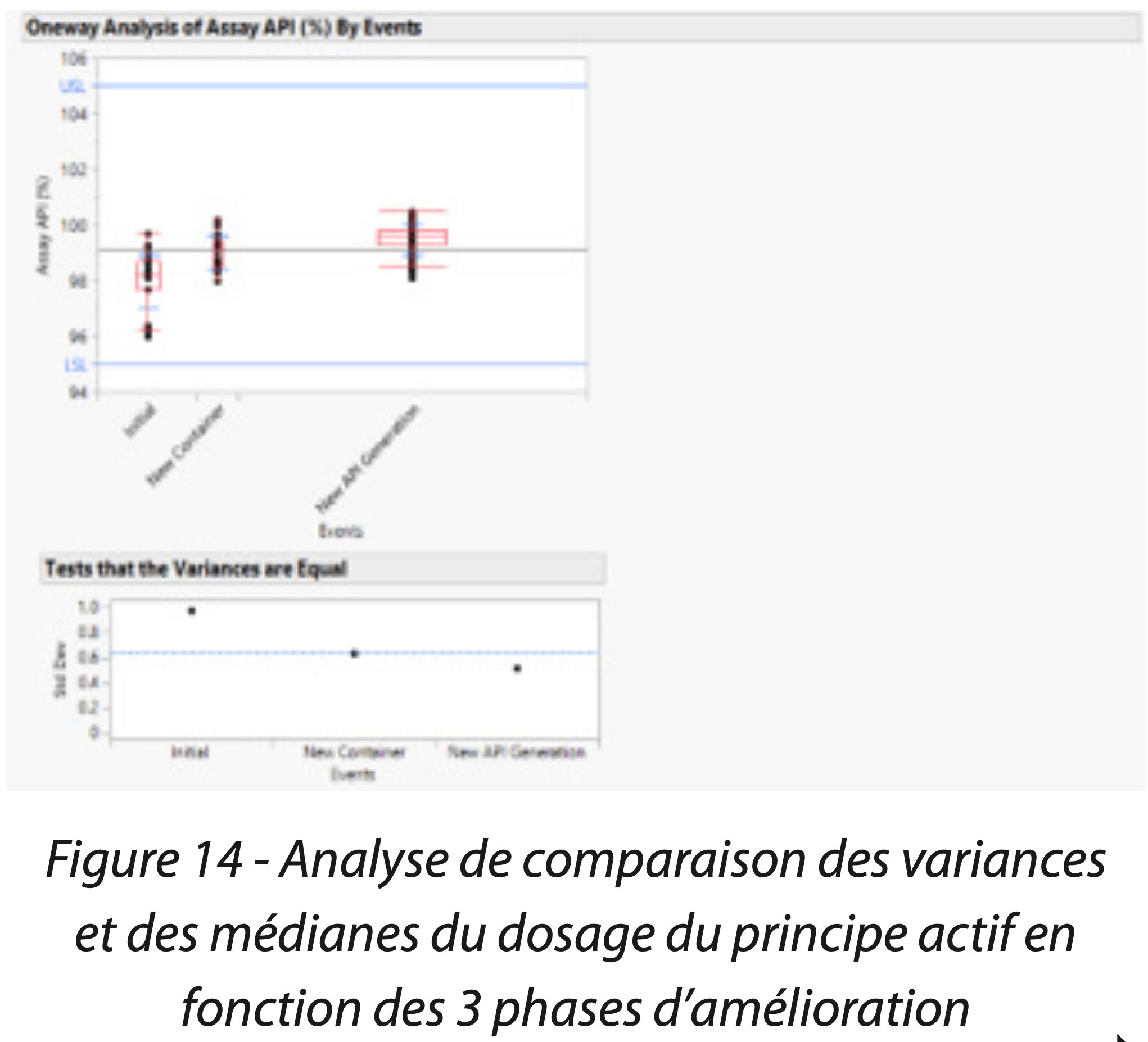
Les indices de capabilité / performance et de stabilité ont tous conclu à un procédé capable et stable dans le temps (Figures 12 et 13). La mise en place de ces solutions a permis de démontrer la maîtrise du procédé de fabrication et de contrôle du produit. La Figure 14 est une analyse de comparaison des variances et médianes du dosage du principe actif en fonction de la phase d’amélioration. Elle confirme que les améliorations successives ont augmenté significativement le taux de principe actif dans le médicament, notamment en réduisant significativement le taux d’impuretés totales, mais également diminué la variabilité (graphique du test de comparaison des variances).
f) Conclusion sur la surveillance d’un produit via le processus CPV
L’exemple du cas réel décrit dans cette section montre que la CPV a non seulement été l’occasion d’approfondir en équipe multidisciplinaire les connaissances sur le procédé de fabrication du médicament dont il est question, mais aussi une opportunité de prévention de non- conformités afin de répondre aux exigences de qualité du médicament administré aux patients et aux objectifs de performances industrielles de l’entreprise.
 |  |  |
Cet exemple souligne donc l’importance du suivi, mais également de la collaboration indispensable pour l’exploration efficace des sources de variabilités d’un procédé pouvant générer des événements de non- qualité.
4. Conclusion générale
Le déploiement du processus CPV dans une industrie pharmaceutique n’est pas anodin tant sa mise en place et sa pratique en routine remanie le fonctionnement des équipes opérationnelles et supports autour du “data driven”. Les bénéfices de cette activité ont un impact certain sur la sécurité et l’efficacité du médicament et les performances de l’entreprise, ce qui justifie amplement les efforts de déploiement, fortement recommandé au travers d’un projet d’amélioration continue.
La CPV a l’avantage de rendre visible l’ensemble des données critiques et pertinentes d’un procédé, offrant le support scientifique nécessaire à l’enrichissement de la connaissance terrain. De plus, l’utilisation des outils de statistiques de procédés permettent de traduire le visuel (carte de contrôle) en données factuelles essentielles à la prise de décision.
C’est à travers le “data driven” que les voix du fournisseur, opérateur, produit, procédé et client sont entendues. La prise en compte de toutes ces voix sont des leviers d’amélioration continue pour l’Excellence Opérationnelle.
5. MEMO. Recommandations
- Considérer l’implémentation CPV comme un projet d’amélioration continue ;
- Bien définir les rôles et responsabilités dans le processus ;
- Considérer l’activité CPV comme une activité associée à l’excellence opérationnelle, en alliant Qualité et Business ;
- Utiliser les résultats de l’activité CPV comme bases de l’amélioration continue des procédés ;
- Être sponsor de la collaboration entre services (avoir le même niveau d’information pour des échanges productifs et compréhensifs) ;
- Centraliser la collecte des données ;
- S’impliquer dans la surveillance / vérifier régulièrement les tendances.
Définitions
Data Driven: Politique de l’industrie 4.0 visant à conduire le changement ou réaliser de la résolution de problèmes basée sur des données factuelles terrain (voix de l’opérateur / process) et transformées (analyse statistique).
DFSS: « Le Design For Six Sigma (DFSS) est une méthode de conception de nouveaux produits ou services, visant à obtenir une qualité similaire à celle obtenue par l’approche Six Sigma, utilisée pour des améliorations de biens ou de process déjà existants. »
SIPOC : vue générale du procédé avec ses données d’entrée et de sortie.
Analyse de déroulement : diagramme détaillé du procédé, impliquant l’ensemble des étapes et sous- étapes de l’activité.
Abréviations
CPV/OPV : Continued Process Verification/On-going Process Verification – Vérification Continue des Procédés
APR / PQR : Revue Annelle Produit
SIPOC : Supplier/ Input/Process/Output/Clients
ICH : International council for harmonization
IPC: In-Process Control
RACI : Responsible (réalisateur), Accountable (approbateur), Consulted (consulté), Informed (informé)
Références
- GMP Volume 4; Annex 15: Qualification and Validation – (2015)
- Process Validation: General Principles and Practices, January (2011)
- ICH Q8 , Quality by Design
- ICH Q9 Quality risks management
- ICH Q10, Pharmaceutical Quality System
- ICH Q12, Technical and regulatory considerations for pharmaceutical product lifecycle management
- FD X06-030 Méthodes statistiques (Statistical Methods)
- ISO 11462- 1&2 Guidelines for implementation of statistical process control (SPC)
- NF X06-031 parts 1, 2, 3, 4 Application de la statistique – cartes de contrôle (Statistics application – Control charts)
- ISO 7870 parts 1, 2, 3, 4, Control charts
- The Six Sigma Handbook-McGraw-Hill (2009)
- MAURICE PILLET- Six Sigma Comment l’appliquer (2004)
- Six Sigma and Lean Concepts: A Novel Approach to Pharmaceutical Industry; Rajesh L. Dumpala, Ms Jaini Bhavsar, Chirag Patil (2020) • Statistics for six sigma green belts with Minitab® and JMP®, David M. Levine (2002)
- The ASQ Pocket Guide for the Certified Six Sigma Black Belt, T. M. Kubiak (2014)
- ISPE – part4-Process Performance and Product Quality Monitoring System (2013)
Partager l’article