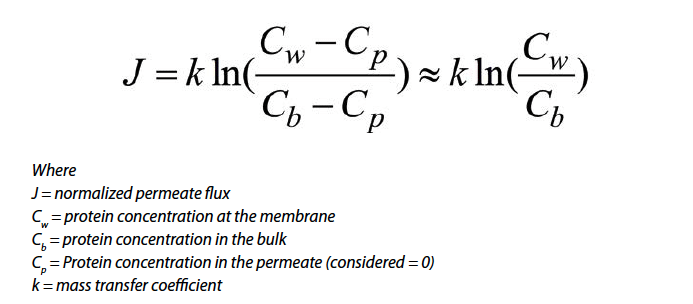Sommaire
- Influence of the hardness of bacteriological culture media on environmental monitoring with impaction type air samplers.
- A New Rapid Microbiology Method based on Measuring Oxygen. Depletion: An Assay for Testing Surfaces of Equipment, Facilities, and Personnel in Pharmaceutical Manufacturing Controlled Environments
- Cahier Pratique – Maîtrise de la qualité des gaz pharmaceutiques
- Sécurité microbiologique des produits cosmétiques : Enjeux et Réalités.
- Development of platform processes for the manufacture of Biopharmaceuticals.
- Développement d’un process Ultrafiltration / Diafiltration pour des applications de haute Concentration / Viscosité.
- Démarrage initial d’une salle propre et redémarrage après un évènement majeur.
Le lancement réussi de plusieurs anticorps monoclonaux (Mab) ces dernières années a mis à jour leur potentiel mais aussi leurs défis de production pour l’injection à dose thérapeutique. Dans ce contexte, la formulation d’un produit fortement concentré est clé pour la réalisation de volumes injectables par voie sous cutanée, typiquement autour de 1mL.
Pour produire des solutions de Mab fortement concentrées à grande échelle (>150g/l), l’ultrafiltration (UF) exige des méthodes fiables et évolutives, sans altérer la qualité de produit.
Les cassettes Pellicon® TFF (filtration de flux tangentielle) sont généralement utilisées pour la concentration et la purification de liquides contenant des macromolécules.
Nouvellement conçues, les cassettes TFF avec promoteur de turbulences D sont capables de traiter des hauts débits de produit à des viscosités élevées. Elles ont été testées utilisant de l’IgG bovine (Immunoglobuline Seracare) comme modèle. Les résultats montrent que la chute de pression le long de la veine liquide a été réduite de plus de 50 % comparée aux dispositifs habituels de TFF en sacrifiant uniquement 15 % du flux filtrat et du transfert de coefficient de masse. Comparé aux autres dispositifs de TFF utilisant une veine liquide plus ouverte, la nouvelle cassette spécialement conçue pour les applications de hautes viscosité/concentration permet d’atteindre les mêmes objectifs de concentration en doublant le transfert de coefficient de masse ainsi que le flux transmembranaire durant la totalité du process.
La sélection des meilleurs paramètres
Les composants principaux dans un processus de TFF sont la membrane et le format du module. Dans les applications de haute concentration de protéine, choisir les composants les plus appropriés durant les phases de développement augmente le succès et la robustesse de l’étape d’ultrafiltration.
Les applications de haute concentration/viscosité présentent des défis supplémentaires comparés aux opérations d’unité de concentration standard. La table 1 décrit la criticité de chacun des paramètres dans le processus de TFF.
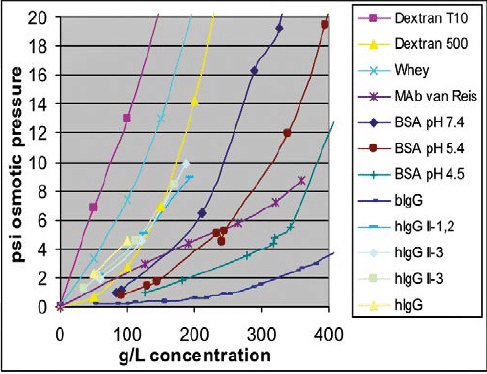
Des données disponibles (Figure 1) montrent que la pression osmotique s’étend seulement entre 1 et 10 psi pour une concentration de 250 g/l pour un Mab ou une IgG. Dans une étape typique en UF, la pression transmembranaire classique se situe entre 15 et 40psi. Cette pression sera finalement toujours plus haute que la pression osmotique et donc l’augmentation de cette dernière en fonction de la concentration ne représentera pas un facteur limitant la performance de l’étape de TFF.
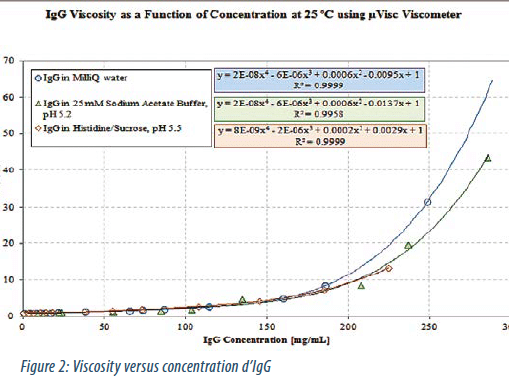
D’autre part, les solutions de protéines montrent des viscosités augmentant très rapidement avec la concentration (Figure 2).
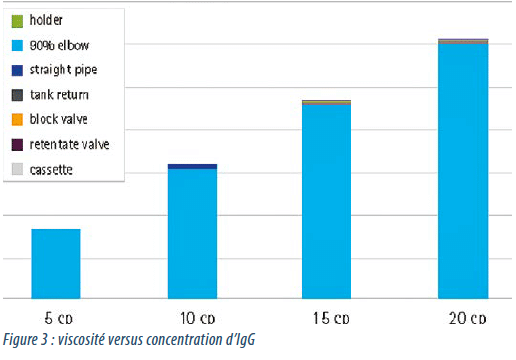
Lorsque la viscosité augmente, la chute de pression augmente de manière proportionnelle. Il a été démontré que dans un système de TFF bien conçu, le composant qui a l’impact le plus important sur la résistance globale du système (la chute de pression) est la cassette TFF elle-même (Figure 3).
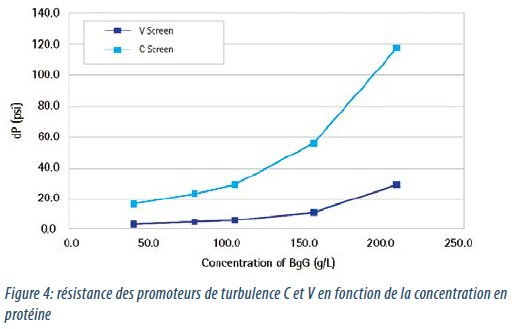
La chute de pression des cassettes d’ultrafiltration (la résistance du module), en raison de la viscosité augmentant lors du processus, est le facteur le plus important affectant la capacité à réaliser des hautes concentrations lors des étapes finales en TFF. Des designs de modules différents exposent des chutes de pression différentes; la figure 4 démontre comment l’utilisation d’un promoteur de turbulence conventionnel (promoteur C ) et un promoteur de turbulence suspendu (promoteur V) impacte sur la résistance de la cassette et le flux.
Un autre paramètre critique essentiel à la réalisation d’un produit de haute concentration/viscosité est la formulation. En effet, en fonction des excipients utilisés, la concentration finale ciblée ne peut être atteinte. Il convient dès lors de mesurer l’influence de chacun de ces excipients sur la viscosité du produit et de les sélectionner soigneusement.
Sélection du promoteur de turbulence
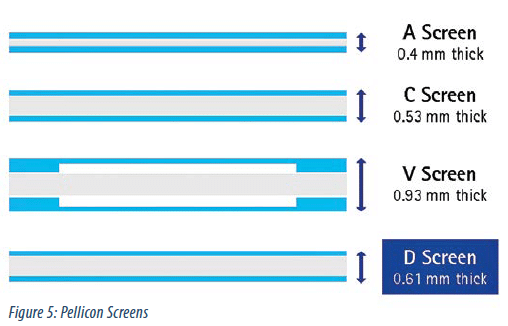
Actuellement dans le format de cassette Pellicon, Merck propose 4 promoteurs de turbulence différents, A, C, D et V (figure 5).
– Le promoteur A est un promoteur “fin”, utilisé pour des solutions protéiques diluées ou de faible viscosité. Le maillage serré de ce promoteur n’est pas approprié pour les solutions très concentrées. En effet aux fortes concentrations, la chute de pression serait trop grande. Cependant grâce à ce promoteur les performances du flux filtrat sont habituellement les meilleures.
– Le promoteur C est un promoteur “large” utilisé pour des solutions ayant une viscosité allant jusqu’à 15cP. Ce promoteur permet d’atteindre de bonnes performances du flux filtrat mais la chute de pression peut être au-dessus de la limite acceptable quand la viscosité augmente.
– Le promoteur V est un promoteur “large suspendu”. Ce promoteur fournit une chute de pression plus petite que le promoteur C mais les performances de flux filtrat sont aussi moins élevées qu’avec le promoteur C.
– Le nouveau promoteur D contient un maillage large et modifié comparé au promoteur C (Figure 5). Ce promoteur a été conçu pour offrir une faible chute de pression sans avoir la même perte de performance de flux filtrat qu’en utilisant un promoteur “suspendu”.
Les promoteurs sont utilisés pour augmenter la turbulence dans les veines liquides et pour améliorer le balayage des solutés retenus de la surface membranaire. Les veines liquides contenant des promoteurs de turbulence affichent des coefficients de transfert plus importants à des débits d’alimentation plus faible. Cela signifie que des flux filtrats plus importants sont atteints avec des besoins plus faibles de pompe. Les veines liquides contenant des promoteurs de turbulence sont donc plus efficaces que les veines liquides ouvertes. Les promoteurs plus fins améliorent le transfert de masse (flux filtrat plus important) mais augmente aussi avec la résistance au débit et donc la chute de pression (Figure 5).
Un compromis est donc nécessaire dans le choix du bon module à utiliser pour les applications de hautes concentrations. Les promoteurs les plus fins fourniront des performances de flux filtrat importantes mais avec des chutes de pression élevées. La sélection du promoteur de turbulence aura pour but d’utiliser le promoteur le plus fin possible tout en restant sous la limite de chute de pression tolérée par le système/cassette à la concentration finale souhaitée.
Etude de comparaison des promoteurs de turbulences C et D à des hautes concentrations de protéine
L’étude interne a été exécutée pour évaluer la résistance des modules de TFF (ou la chute de pression ou dP) par rapport à une protéine (IgG) concentrée.
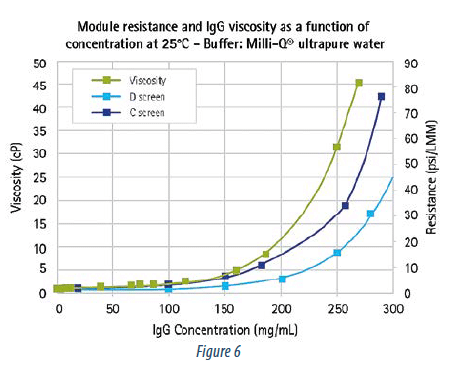
La chute de pression à travers la veine liquide pour des cassettes avec des promoteurs de turbulences différents est montrée dans la Figure 6.
À un flux d’alimentation donné, les chutes de pression augmentent avec “la finesse” du promoteur. Plus la résistance de la veine liquide est basse, plus la concentration pouvant être atteinte est haute. En effet, la chute de pression (courbes bleue et rouge) est liée à la concentration de protéine et sa viscosité (courbe verte).
La nouvelle cassette avec promoteur de turbulence D permet une chute de pression d’environ 50 % comparée au promoteur C. Une étape de concentration comparative a également été exécutée à 3 flux d’alimentation différents (3 – 5 et 7 L/min/m ²).
Le flux versus la pression transmembranaire (TMP) avec une solution concentrée à 20 g/L d’IgG bovine a permis de déterminer les paramètres optimaux.
La solution IgG a été concentrée autant que possible en utilisant le procédé suivant :
– Maintien de la TMP constante aussi longtemps que possible en ouvrant la vanne rétentat jusqu’à ce que la pression rétentat atteigne 2-3 Psig ;
– Puis maintien du débit d’alimentation aussi longtemps que possible jusqu’à un maximum de Pinlet = 60 Psig ;
– Enfin, réduire le débit d’alimentation afin de maintenir une Pfeed à une Pinlet max= 60Psig jusqu’à ce que le débit minimal soit atteint (limite générée par les capacités de la pompe d’alimentation) ou que le flux soit de 0.
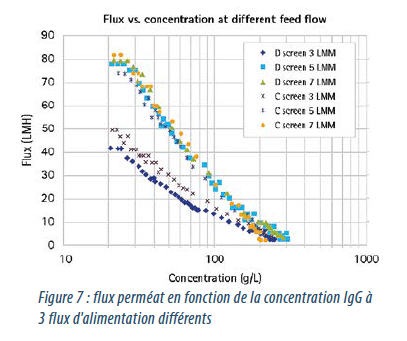
Le graphique dans la Figure 7 montre le flux en fonction des courbes de concentration pour des promoteurs de turbulences différents. Par le modèle de film stagnant empirique, les pentes représentent le coefficient de transfert de masse pour chaque dispositif.
Le coefficient de transfert de masse et Cw ont été déterminés en calculant la pente absolue du flux versus la concentration initiale selon l’équation de modèle du film stagnant prenant en compte les données avant que la pompe ne soit ralentie :
La concentration de protéine initiale et finale a été déterminée par la mesure UV.
Des résultats expérimentaux sont récapitulés dans la table suivante, comparant le promoteur de turbulence D aux performances du promoteur C :
Le flux du promoteur de turbulence D durant l’étape de concentration est semblable au promoteur C à un débit d’alimentation supérieur à 5 L/min/m², cependant le promoteur D a pu atteindre une concentration finale plus haute de 20 %.
Le flux moyen avec promoteur D est 75 % supérieur au promoteur C à un débit d’alimentation de 3 L/min/m², mais une concentration finale plus haute de 10 % a pu être atteinte.
Dans toutes ces expériences, le promoteur de turbulence D a pu atteindre une concentration finale plus haute que le promoteur C.
Conclusions
La haute concentration de protéine par TFF UF est un défi. D’un point de vue opérationnel avec l’augmentation de concentration de protéine, l’augmentation de viscosité et la résistance de module oblige l’opérateur à trouver un compromis entre la chute de pression (la résistance de module) et le flux à la concentration finale.
Le choix du dispositif TFF est clé pour un processus efficace et à haute performance. Les nouvelles cassettes Pellicon 3 avec promoteur de turbulence D, accompagné des meilleures conditions d’utilisation, permet d’obtenir des concentrations finales plus élevées avec des flux similaires. L’utilisation de débits d’alimentation raisonnables est cependant un facteur dépendant de la performance finale.
La table 3 présente un résumé des performances des cassettes Pellicon 3 avec promoteur de turbulence D par rapport au promoteur de turbulence C.
Suite aux résultats des expérimentations internes et externes, le promoteur de turbulence D :
– est approprié pour les applications de haute concentration en TFF UF.
– a pu traiter des viscosités 2 à 3 fois plus élevées à des flux supérieurs comparés au promoteur de turbulence C.
– a atteint des concentrations finales de produit de +4 à +25 % comparées au promoteur de turbulence C.
– a montré une réduction de 0 à 24 % du transfert de coefficient de masse comparé au promoteur de turbulence C.
– a exigé 5 à 25 % de surface membranaire supplémentaire comparé au promoteur de turbulence C pour un processus similaire. L’amélioration est significative par rapport au promoteur de turbulence V qui exige 2 fois plus de surface membranaire.

Fréderic SENGLER – MERCK LIFE SCIENCE
frederic.sengler@merckgroup.com

Josselyn HAAS – MERCK LIFE SCIENCE

Renato LORENZI – MERCK LIFE SCIENCE
Partager l’article
Glossaire
RMab : Monoclonal Antibody
IgG : Immunoglobuline
UF : Ultrafiltration
TFF : tangential flow filtration
dP : Pressure drop
Bibliographie
– F Sengler, J Haas, R Lorenzi : Poster UF/DF process development of high concentration/Viscosity applications, 2015
– TFF Membranes for High MAb Concentration, Géraldine Eschbach and Steve Vermant, 2008
– Ultrafiltration for Bioprocessing book, Herb Lutz, 2015
– Vilker VL, The osmotic pressure of concentrated protein and lipoprotein solutions ans its significance to ultrafiltration, 1981