Sommaire
- Quality Metrics: Why do manufacturers not support the FDA initiative anymore?
- Nouvelle réglementation pour dispositifs médicaux : les défis expliqués.
- Les avancées des Procédés de Hautes Pressions Hydrostatiques (HHP) dans l’obtention d’une assurance de stérilité de 10-6 : Principes & Applications pratiques
- Traitement par le peroxyde d’hydrogène vaporisé : de la décontamination à la Stérilisation ?
- Essais d’intégrité des contenants (CCIT) pour les systèmes « Single Use »
- Les nouvelles exigences des bonnes pratiques de fabrication européennes concernant la Validation du Nettoyage
- Endotoxin masking hold-time study parameter determination and performance
- Optimiser vos systèmes Qualité en changeant de paradigme : placer l’opérateur au centre des systèmes
Historiquement les tests d’intégrité des contenants étaient réalisés par la méthode au bleu (Dye test) ou par la méthode microbiologique (microbial challenge). L’article du PDA journal(1) “Development of a Dye Ingress Method to Assess Container-Closure Integrity Correlation to Microbien Ingress” est l’un des textes de référence dans le domaine.

Mais il existe aujourd’hui de nombreuses méthodes physiques plus sensibles qui permettent notamment la réalisation de tests d’intégrité en ligne à grande cadence, pourtant les tests au bleu de méthylène et microbiologiques restent intéressants et présentent différents avantages.
En 2016, le Chapitre[2] “<1207> Package integrity evaluation – sterile products” de l’USP a été mis à jour, remettant sérieusement en cause l’unique utilisation des méthodes historiques telles que les tests au bleu ou les tests microbiologiques. Dans ce Chapitre, la méthode microbiologique est nommée “Microbial Challenge, Immersion Exposure” et la méthode au bleu est comprise dans les méthodes dites “Tracer Liquid”. Ces deux méthodes sont catégorisées comme des “probabilistic methods”. Les méthodes probabilistes se caractérisent par la nature aléatoire des phénomènes permettant le passage du liquide dans les échantillons. A l’opposé l’USP définit les “deterministic methods” comme des techniques physico-chimiques permettant l’obtention de résultats quantifiables, reproductibles avec des limites de détection clairement définies et prévisibles.
Principe et points importants
Pour les deux cas, la méthode microbiologique ou au bleu, le principe de base est similaire. Il s’agit de détecter le passage d’un liquide à l’intérieur d’un contenant. Le passage du liquide est relevé par une coloration ou un développement microbien.
- Méthode microbiologique
Les échantillons doivent d’abord être remplis de milieu permettant une croissance microbiologique. Généralement il s’agit d’un milieu de culture standard de type TS. A noter, qu’un produit contenant suffisamment de substance nutritive peut être directement utilisé comme milieu de croissance. Dans ce cas, la fertilité du produit par rapport au germe de test doit être évaluée avant la réalisation des essais. L’utilisation du produit comme milieu de croissance a l’avantage d’éviter la production d’un lot particulier et/ou permet la réalisation de test dans le cadre d’une investigation.Les échantillons sont ensuite immergés dans une solution de micro-organismes. Les micro-organismes les plus couramment utilisés étant Brevundimonas diminuta, Serratia marcesans ou Escherichia coli. Dans le but de challenger un échantillon avec une souche particulière, d’autres micro-organismes peuvent être utilisés comme des souches in-house. A noter que certains micro-organismes ont besoin de paramètres particuliers de croissance qui doivent être pris en compte lors du choix de la souche de test. C’est par exemple le cas de Brevundimonas diminuta, celui-ci étant aérobie strict, il faut s’assurer que le milieu de croissance contient de l’oxygène.A la fin du cycle d’immersion, les échantillons sont nettoyés puis incubés un temps suffisant pour permettre la croissance des micro-organismes. Concernant le temps d’incubation, il n’y a pas de temps standard, par défaut 7 ou 14 jours sont généralement utilisés mais si un temps inférieur permet la détection d’une croissance microbienne, celui-ci peut être choisi.Après cette période d’incubation, les échantillons sont directement observés pour la détection d’un trouble. Généralement, si les conditions du test ont correctement été sélectionnées, il n’y aura aucun doute en cas de pousse. Néanmoins, une analyse du contenu des échantillons peut également être réalisée afin de détecter la présence de micro-organismes. Cette analyse doit être réalisée si les contenants ne permettent pas une lecture d’un trouble ou si le milieu de croissance ne le permet pas ou en cas de doute sur la présence d’un développement microbien.
- Méthode au bleu
Les échantillons sont d’abord remplis de produit. Un échantillon vide peut également être testé mais généralement le passage est favorisé entre deux liquides. Les échantillons sont ensuite immergés dans une solution de colorant. Différents colorants peuvent être utilisés, historiquement il s’agit de bleu de méthylène. A la fin du cycle d’immersion, les échantillons sont nettoyés puis lus. La lecture des échantillons peut se faire visuellement ou à l’aide de spectrophotomètre.
Les témoins positifs
En parallèle des tests, des témoins positifs doivent être effectués en utilisant des échantillons dans lesquels des “trous” sont réalisés. L’utilisation des échantillons plutôt que de témoins standards permet de simuler réellement le test. Par rapport à certaines méthodes déterministes, l’utilisation de témoin positif permet de revérifier à chaque session de test, la limite de détection sur l’échantillon réel. A noter que les limites de détection varient en fonction du type de contenant. Plus le contenant est grand (plusieurs litres, par exemple), plus la limite de détection sera importante. La limite de détection est corrélée à la capacité du liquide à pénétrer le contenant. Par exemple, pour une poche souple de liquide de 20 Litres, la limite de détection sera généralement supérieure à 100μm alors que pour une seringue ou un acon de quelques millilitres, la limite de détection pourra être abaissée à 2-5μm avec des variations de pression suffisamment fortes. En comparaison, selon l’USP, une méthode déterministe utilisée pour des tests rapides en ligne, permet de détecter des défauts de l’ordre de 25-100μm. Alors que ces mêmes méthodes hors ligne permettent de détecter des défauts de moins de 1μm.
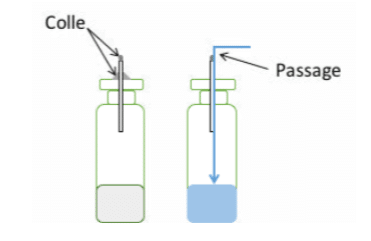
Afin de générer les témoins positifs, des microtubes ou microcapillaires peuvent être utilisés pour simuler les micro-trous dans les échantillons. La réalisation des témoins positifs est une tâche délicate. Durant la préparation puis durant l’insertion des capillaires dans les échantillons, il est important de ne pas boucher les capillaires ni de les casser. Un autre point essentiel réside dans la fixation des capillaires. Si un capillaire n’est pas scellé ou pas correctement scellé à l’échantillon, le liquide passera à côté de celui-ci plutôt qu’à l’intérieur (voir figure 1), ceci même si le capillaire est introduit dans un bouchon caoutchouc. Celui-ci ne se rétracte pas parfaitement autour du capillaire et laisse un passage pour le liquide. A noter qu’il existe également une corrélation entre la longueur des capillaires et la probabilité de passage à travers celui-ci, d’où la nécessité de réaliser une validation avant d’entreprendre des tests de routine.
Inconvénients
Les deux méthodes présentent un certain nombre d’inconvénients connus :
- Ce sont des méthodes “destructives”, dans les deux cas les échantillons ne devraient pas être réutilisés,
- Directement lié au point précédent, il faut gérer les déchets générés,
- Les limites de détection sont relativement hautes, néanmoins elles peuvent se rapprocher des méthodes déterministes en appliquant de fortes variations de pression,
- Le temps d’analyse est long, particulièrement pour les tests microbiologiques, entre 1 jour et 14 jours,
- Pour les tests microbiologiques, il est nécessaire d’utiliser un milieu permettant la croissance du germe sélectionné.
Avantages
Malgré les inconvénients relativement importants de ces méthodes, différents avantages demeurent.
1.Les variations de pression
L’un des principaux avantages est la possibilité d’exposer les échantillons à différentes variations de pression. Aujourd’hui, différentes sociétés challengent leurs produits avec des conditions spécifiques mimant au mieux le transport de leurs produits. Certains échantillons sont ainsi immergés dans une solution et subissent par exemple une série de dépression afin de simuler plusieurs vols en avion. Néanmoins, la variation de pression doit être suffisante pour libérer les bulles d’air qui empêcheraient le passage de liquide à travers les microtubes. La différence de pression est donc directement corrélée à la limite de détection du test. Comme indiqué plus haut, l’utilisation de grande variation de pression permet de se rapprocher des limites de détection des technologies déterministes, mais il est important de prendre en considération la structure des échantillons. Pour les échantillons présentant une partie mobile, tel que les bouchons de caoutchouc des seringues, une trop forte variation de pression génère un déplacement important des bouchons et donc un risque de faux positif. L’utilisation de pression correspondant aux variations de pression subies par les produits lors des transports aériens permet justement de mimer les mouvements des parties mobiles sans générer de faux positifs. Ce dernier point très important, permet de vérifier le risque de contamination microbiologique lors du déplacement des parties mobiles des produits lié aux variations de pression. Mais il faut garder à l’esprit que les variations de pression mimant les transports aériens, sont relativement faibles donc les limites de détection lors de ces tests sont relativement grandes.
2.Les gros volumes
Pour un grand nombre de méthodes permettant de vérifier l’intégrité des échantillons, la taille des échantillons peut devenir rapidement un facteur limitant. Pour les tests au bleu et microbiologiques, la limite de taille pour réaliser un test est relativement élevé. Afin de réaliser les tests, des containers spécifiques de grandes tailles sont fabriqués (voir photo 1). Il est alors nécessaire de fabriquer une quantité importante de solution d’immersion pour garantir le challenge de l’ensemble des surfaces de l’échantillon.
Les containers sont ensuite introduits dans une chambre suffisamment grande pour réaliser les cycles de variation de pression (voir photo 2). Dans le cas d’étude sur des contenants de grand, voire de très grand volume, les études sont relativement longues car chaque échantillon devra être testé individuellement. De plus, pour les tests microbiologiques, une chambre d’incubation suffisamment grande devra être utilisée. Enfin, il sera également plus difficile de gérer la destruction des échantillons.
3. Simplicité de mise en place
La réalisation des tests au bleu et microbiologiques présente également l’avantage d’une relative simplicité de mise en place. Dans le cas des tests microbiologiques, si la lecture est réalisée visuellement, seul un appareil permettant de faire varier la pression est nécessaire en plus du matériel standard d’un laboratoire de microbiologie.
Il faudra donc :
- Un contenant pour l’immersion et le challenge de l’ensemble des surfaces des échantillons, qui doit être stérilisable et/ou stérile,
- Les échantillons contenant un milieu permettant la croissance du germe,
- Un appareil permettant la réalisation des variations de pression,
- Des incubateurs ou chambres d’incubation,
- Les milieux de culture et micro-organismes afin de préparer les solutions d’immersion,
- Des capillaires ou microtubes, si ceux-ci sont sélectionnés pour la réalisation des témoins positifs.
Pour les réalisations des tests au bleu, en plus de l’équipement permettant les variations de pression, le matériel standard d’un laboratoire de chimie est suffisant.
- Un contenant pour l’immersion des échantillons,
- Des échantillons,
- Un appareil permettant la réalisation des variations de pression,
- Une cabine de lecture ou un spectrophotomètre selon le type de lecture,
- Des capillaires ou microtubes, si ceux-ci sont sélectionnés pour la réalisation des témoins positifs.
Dans les deux cas, un appareil unique peut être utilisé pour réaliser les tests. En fonction de la taille de l’appareil, des contenants plus ou moins importants pourront être évalués.
Il existe d’autres applications aux tests microbiologiques ainsi qu’au Dye Test non décrites dans l’USP. Parmi celles-ci voici deux exemples couramment utilisés :
- Dans le cas du Dye Test, un test permet la détection de défaut de soudure au niveau des packagings poreux (ASTM F 1929[3]). Dans le cadre de ce test, il existe deux possibilités : soit le packaging est rempli de colorant soit inversement le packaging est plongé dans une solution.
- Pour le cas des tests microbiologiques, il est également possible d’utiliser les bactéries sous forme d’aérosol afin de challenger l’intégrité d’un échantillon en simulant une atmosphère saturée en micro-organismes
Conclusion
Les tests historiques au bleu de méthylène ou les tests microbiologiques sont depuis quelques années concurrencés par de “nouvelles” technologies très performantes. Ces technologies appelées déterministes garantissent une limite de détection connue. Mais malgré les défauts connus des méthodes historiques, la relative simplicité, la rapidité de mise en place et le faible coût en font des méthodes toujours utiles. De plus, ces méthodes apportent une solution pour les tests d’intégrité sur les produits très volumineux. Plus important encore, elles permettent de vérifier l’impact du déplacement des parties mobiles d’un produit (exemple : bouchon) sur le risque de contamination microbiologique.

Lionel KARCHER – CONFARMA
lkarcher@confarma.fr
Partager l’article
Références
[1] USP 39 (1207.1) Package integrity testing in the product life cycle – test method selection and validation.
[2] PDA, Development of a Dye Ingress Method to Assess Container-Closure Integrity: Correlation to Microbial Ingress
[3] ASTM, F 1929 Standard Test Method for Detecting Seal Leaks in Porous Medical Packaging by Dye Penetration
Glossaire
CCIT: Container Closure Integrity Test CTA : Centrale de Traitement d’Air
TS : Trypticase Soja
USP: The U.S. Pharmacopeial Convention