Sommaire
- Le GIC A3P Validation du Nettoyage prépare un guide pratique pour l’automne 2017 sur le Chapitre 10 de l’Annexe 15 des GMP Européennes : Présentation & discussion.
- Stratégies de regroupement des nettoyages pour les formes orales solides dans les établissements multi-produits
- La réglementation biocide appliquée aux désinfectants utilisés dans l’Industrie Pharmaceutique : ce qu’il faut savoir…
- Cahier Pratique – Comment assurer le succès d’une auto-inspection du processus d’assurance de stérilité & des procédures associées
- La cryogénie est l’étude et la production des basses températures
- Stratégie de contrôle de nettoyage dans le cadre de la fabrication de Principes Actifs pharmaceutiques en développement à usage clinique
- Le contrôle visuel indirect modernise la validation du nettoyage
- La détermination du taux de recouvrement est une étape préliminaire, nécessaire lors d’un exercice de validation du nettoyage
- Cleaning Validation for biotechnological substances : What acceptance criteria ?
- “Health-based approach” implementation for setting limits in cleaning validation for Vaccines/Biotech
Les produits désinfectants et détergents désinfectants sont très utilisés en industrie pharmaceutique pour des usages divers incluant des opérations qualifiées de décontamination ou des applications appelées “nettoyage ou lavage ou encore sanitation” aussi bien pour les locaux que pour les équipements et matériels de fabrication.
Le règlement biocide N° 528/2012 en vigueur en Europe depuis le 1er septembre 2013 va impacter le devenir des produits désinfectants, les pratiques actuelles ainsi que les modalités d’application mises en oeuvre aujourd’hui. L’objectif de l’article est d’informer sur cette réglementation et ses impacts sur les usages des sites pharmaceutiques : quelles sont les substances actives autorisées, le calendrier de dépôt des dossiers de demande d’AMM, les responsabilités des fournisseurs de désinfectants et des sites utilisateurs…
Rappel réglementaire :
Le règlement biocide (BPR) concerne les produits biocides et les articles traités. Il s’inscrit dans la continuité de la directive biocide 98/8/CE du 16 février 1998 qui pendant une période d’environ 10 ans, a mis en place un processus d’identification puis de notification des substances actives par les fabricants et enfin leur évaluation par les autorités compétentes du pays européen concerné. Des étapes clefs se sont succédées et enfin, depuis le 1er septembre 2013, l’entrée en vigueur du règlement biocide concernant l’autorisation de mise sur le marché et l’utilisation des produits biocides en substitution de la directive.
Le règlement a été applicable immédiatement à cette date dans tous les Etats membres. Il introduit de nouvelles terminologies, renforce globalement le niveau d’exigences pour un plus haut niveau de protection de l’homme et de l’environnement, prend en compte en tant que biocides, les articles traités, introduit un système de partage des données et la possibilité d’autorisation pour un produit au niveau de toute l’Union.
Le règlement biocide reprend les mêmes objectifs que la directive qu’il remplace. Il s’inscrit dans une volonté, au niveau européen, de maîtrise de l’efficacité des produits biocides dans le respect de la santé humaine et animale et de l’environnement. Les deux grands principes instaurés sont dans un premier temps, l’approbation des substances actives biocides pour certains usages, dénommés type de produit (TP), puis l’autorisation des produits biocides pour des applications données.
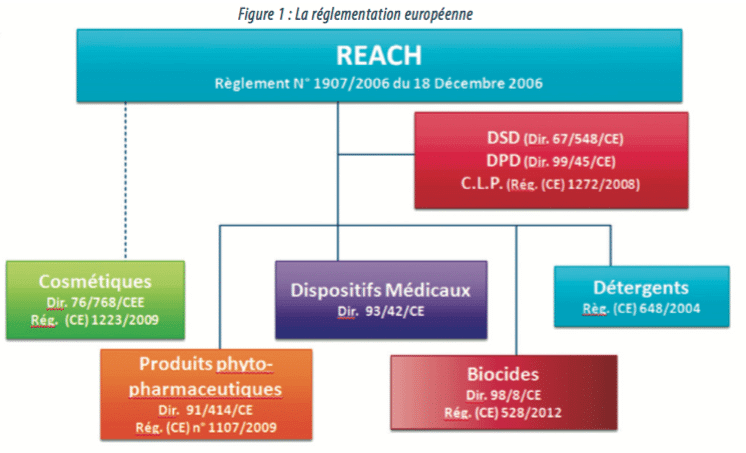
Ce règlement s’inscrit dans la continuité d’un certain nombre de textes européens, tels que le règlement REACH, le règlement CLP, la directive dispositifs médicaux, la directive cosmétiques… définissant ainsi le statut réglementaire de bon nombre de produits sur le marché.
Définition :
Le terme biocide est applicable à toute substance active, générée in situ ou non, et aux produits qui contiennent des mélanges de substance actives.
Un produit biocide vise à détruire, repousser ou rendre inoffensifs les organismes nuisibles, à en prévenir l’action ou à les combattre de toute autre manière, par une action autre qu’une simple action physique ou mécanique.
On définit un article traité ainsi : toute substance, tout mélange ou tout article qui a été traité avec un ou plusieurs produits biocides ou dans lequel un ou plusieurs produits biocides ont été délibérément incorporés.
Il a été également défini la notion de “famille de produits” permettant de regrouper un groupe de produits biocides ayant : des utilisations similaires, les mêmes substances actives biocides, une composition similaire dont les variations sont spécifiées et des niveaux de risque et d’efficacité similaires. Les produits qui répondent à la définition de biocide sont classés en 4 groupes au sein desquels sont définis des types de produits au nombre de 22.
La description de chaque type de produit figure à l’Annexe V du règlement N° 528/2012 (figure 2).
- Groupe 1 : Désinfectants
- Groupe 2 : Produits de protection (bois, cuir, matériaux de construction, fluides de coupe,…)
- Groupe 3 : Produits de lutte contre les nuisibles
- Groupe 4 : Autres produits biocides
Ainsi au sein du groupe 1 des désinfectants, on définit 5 TP :
TP 1 : Produits biocides destinés à l’hygiène humaine.
Ne sont pas concernés :
– les produits d’antisepsie de la peau pouvant être appliqués sur une peau lésée ou en vue d’être lésée (répondant aux exigences de la directive relative aux spécialités pharmaceutiques)
– les produits cosmétiques : produits d’hygiène corporelle et de soins de la peau (répondant au règlement cosmétique)
TP 2 : Désinfectants et produits algicides non destinés à l’application directe sur des êtres humains ou des animaux.
Il s’agit notamment :
– de produits utilisés pour désinfecter les surfaces, les matériaux, les équipements et le mobilier qui ne sont pas
utilisés en contact direct avec les denrées alimentaires ou les aliments pour animaux.
– de produits utilisés pour désinfecter l’air, les eaux non utilisées pour la consommation humaine ou animale, les toilettes chimiques, les eaux usées, les déchets d’hôpitaux et le sol.
Ne sont pas concernés :
les produits destinés spécifiquement à la désinfection des dispositifs médicaux ; ceux-ci relèvent de la directive relative aux dispositifs médicaux.
TP 3 : Produits biocides destinés à l’hygiène vétérinaire
TP 4 : Désinfectants pour les surfaces en contact avec les denrées alimentaires et les aliments pour animaux
TP 5 : Désinfectants pour eau de boisson
Ainsi, en industrie pharmaceutique, les produits biocides destinés à la désinfection des surfaces environnementales et des surfaces des équipements et matériels de production, sont des biocides du groupe 1 et TP 2 ; on trouvera également dans les sites pharmaceutiques, des biocides TP 1 pour la désinfection des mains et, dans certains secteurs, des produits relevant du TP 4.
Dans certains cas, certains produits pourront avoir un double statut, tel que biocide et dispositif médical et/ou faire partie de deux ou trois TP différents avec des modalités d’utilisation différentes.
Mise en oeuvre
La mise en oeuvre de ce règlement est centralisée par l’ECHA, agence européenne des produits chimiques, localisée à Helsinki.
Une plateforme informatique spécialisée a été créée (registre des produits biocides : R4BP) pour présenter les demandes, pour l’échange des données et des informations entre le demandeur, l’ECHA, les autorités compétentes de l’Etat membre et la Commission européenne.
Tous les produits biocides destinés à être mis sur le marché en Europe requièrent une autorisation, au niveau de l’État membre, pouvant être étendue à d’autres États membres par reconnaissance mutuelle.
Ainsi, on pourra trouver 4 types d’autorisation :
La commercialisation des produits biocides en Europe sera soumise à l’obtention d’une autorisation de mise sur le marché (AMM biocide), une fois l’examen de la (les) substance(s) active(s) terminé.
Seuls les produits biocides contenant des substances actives inscrites sur les listes positives ou en cours d’évaluation peuvent faire l’objet d’une demande d’autorisation de mise sur le marché (AMM).
L’évaluation est effectuée selon le concept du rapport bénéfice/risque (appréciation des performances du produit avec prise en compte des effets secondaires en terme de danger pour la santé et l’environnement).
Dans l’intervalle, des mesures transitoires générales s’appliquent aux produits et les dispositions nationales en place doivent être respectées dans les pays de commercialisation.
L’évaluation des substances biocides est actuellement en cours au niveau européen :
évaluation par une autorité compétente de l’Etat membre rapporteur, responsable de l’évaluation ; les résultats sont transmis au comité des produits biocides de l’ECHA qui prépare une “opinion” qui servira de base à l’approbation par la Commission européenne.
L’approbation est accordée pour au maximum 10 ans et est renouvelable.
En principe, les substances actives remplissant les critères d’exclusion ne seront pas approuvées. Celles-ci comprennent :
– les substances cancérogènes, mutagènes et toxiques pour la reproduction de catégorie 1A ou 1B conformément au règlement CLP,
– les perturbateurs endocriniens,
– les substances persistantes, bioaccumulables et toxiques (PBT)
– les substances très persistantes et très bioaccumulables (vPvB).
Des dérogations sont prévues, notamment lorsque la substance active est nécessaire pour des raisons de santé publique ou d’intérêt public et qu’il n’existe pas de remplacement ; dans ce cas, l’approbation est accordée pour un maximum de cinq ans.
Aujourd’hui, l’évaluation des substances biocides est toujours en cours et un calendrier d’examen des substances jusqu’en 2024 a été établi pour terminer la revue de l’ensemble des substances biocides.
Ce nouveau délai ne dispense pas des obligations déjà applicables, notamment en terme de formulation (utilisation d’actifs biocides en cours d’examen) et d’étiquetage.
Concernant les substances biocides désinfectantes, à ce jour, seule l’évaluation de quelques substances est terminée.
L’approbation de la substance active pour un usage en tant que biocide dans un domaine d’application donné est officialisée par la parution au JO de l’Union Européenne (figure5).
Exemples de règlements d’exécution portant approbation d’un couple SA/TP :
– Règlement d’exécution (UE) 2016/1083 de la Commission du 5 juillet 2016 approuvant les “produits de la réaction entre l’acide chloroacétique et les N-C10–16-alkyltriméthylènediamines” en tant que substance active existante destinée à être utilisée dans les produits biocides des types de produits 2, 3 et 4 (JOUE L180 du 6 juillet 2016).
– Règlement d’exécution (UE) 2016/1084 de la Commission du 5 juillet 2016 approuvant le biphényl-2-ol en tant que substance active existante destinée à être utilisée dans les produits biocides du type de produit 3 (JOUE L180 du 6 juillet 2016).
Actuellement, l’examen se poursuit et les approbations seront progressivement publiées au cours des 5 ans à venir. Les dossiers de demande d’autorisation de mise sur le marché des produits désinfectants les contenants devront être déposés dans les 18 mois à 2 ans suivant la date de diffusion d’opinion du groupe Biocidal Products Committee concernant la substance active (dernière date d’approbation en cas de produits contenant plusieurs substances actives).
Des obligations concernent également les fournisseurs de substances actives :
Depuis le 01/09/2015, un produit biocide ne peut être mis à disposition sur le marché de l’Union Européenne qu’à condition que, soit le fournisseur de la substance, soit le fournisseur du produit soit inclus dans la liste de l’article 95 du règlement biocide pour ce type de produit.
Seules les personnes établies au sein de l’UE peuvent faire une demande d’inclusion sur la liste des fournisseurs de substances actives (liste de l’article 95).
Quelle situation actuellement en France ? Quelles conséquences pour les utilisateurs ?
La période transitoire définie par l’article 89 du règlement biocide correspond à la période actuelle au cours de laquelle, la mise à disposition sur le marché et l’utilisation des produits biocides sont régies par les dispositions nationales en vigueur dans chaque Etat membre, dans l’attente que toutes les substances actives que contiennent ces produits soient approuvées au niveau communautaire.
Aujourd’hui, en France l’autorité compétente est l’ANSES (Agence Nationale de Sécurité Sanitaire de l’Alimentation, de l’environnement et du travail).
Les mesures transitoires générales applicables en France sont les suivantes :
• les substances biocides contenues dans un produit doivent être dans le programme d’examen européen en vue d’une approbation d’emploi pour le type de produit adéquat (seule l’utilisation de produits biocides désinfectants et détergents désinfectants formulés avec des substances actives notifiées et en cours d’évaluation pour l’usage adéquat est possible).
• les preuves d’efficacité doivent s’appuyer sur les systèmes normatifs disponibles (conformité EN 14885)
• les produits doivent être déclarés sur le site Simmbad du Ministère de l’environnement inventoriant l’ensemble des produits biocides mis sur le marché français (http://simmbad.fr/servlet/accueilMinistere.html),
• les compositions des produits doivent être déclarées à l’INRS à des fins de toxicovigilance,
• l’encadrement de certains produits biocides par le CERTIBIOCIDE (Arrêté du 9 octobre 2013 relatif aux conditions d’exercice de l’activité d’utilisateur professionnel et de distributeur de certains types de produits biocides).
Outre les obligations applicables aux fabricants de substances biocides et aux formulateurs utilisant ces substances, le règlement biocide englobe des obligations pour les utilisateurs des dits produits biocides.
Après la fin de la période transitoire, l’utilisateur aura obligation d’utiliser des produits avec AMM (Autorisation de Mise sur le Marché). Il importera aux utilisateurs de s’assurer que les indications d’usage ainsi que les conditions d’emploi (dilution, temps de contact, température) décrites dans les protocoles d’hygiène, soient en accord avec les conditions d’AMM du produit. Toute application d’un produit biocide devra être reprise dans les strictes conditions de l’AMM.
En raison de l’investissement requis, on s’oriente à l’avenir vers une réduction du nombre de produits disponibles avec une spécialisation de la profession. Cette évolution réglementaire à l’échelle eurppéenne est certes contraignante mais, néanmoins positive pour l’avenir de l’homme et de l’environnement conduisant à des produits plus respectueux de l’homme et de l’environnement ; elle encadre une meilleure maîtrise des risques et effets secondaires et la garantie de performances accrues.




